Une nouvelle étude éclaire la dégénérescence régionale dans la MH
Pourquoi certaines cellules cérébrales meurent-elles dans la MH ? De nouvelles recherches suggèrent que cela pourrait être dû à l’efficacité du recyclage cellulaire
Certaines régions du cerveau dégénèrent plus rapidement que d’autres dans la maladie de Huntington. L’équipe de Steven Finkbeiner conclut que cette différence est basée sur les capacités variables des cellules cérébrales de ces régions à identifier et éliminer rapidement la protéine MH mutée. Plus précisément, les neurones des régions cérébrales vulnérables sont les plus lents à éliminer la protéine.
Savoir quand plier bagage
Les protéines sont de grandes molécules biologiques qui effectuent diverses tâches essentielles pour la cellule. Une fois qu’une protéine a été fabriquée en assemblant des acides aminés dans un ordre spécifique, elle se replie comme un bretzel dans une forme tridimensionnelle unique. Ce n’est que lorsque la protéine est correctement repliée qu’elle peut accomplir sa fonction normale.
Malheureusement, certaines protéines sont altérées en cours de route et ne se replient plus correctement. Dans la MH, une mutation génétique fait qu’un des acides aminés dans la chaîne de la protéine huntingtine (Htt) se répète encore et encore, comme un disque qui saute (ou un bégaiement, si les disques sont avant ton époque).
Cette expansion fait que la Htt se replie incorrectement, devient toxique pour la cellule et s’agglomère en gros amas que les scientifiques appellent agrégats. Une image appropriée serait celle de boules de cheveux bouchant un drain : les cheveux individuels ne posent pas de problème, mais les gros amas le bouchent.
Chez les patients atteints de MH, chaque cellule du corps semble avoir de la protéine MH mutée, mais ce sont les cellules cérébrales qui meurent préférentiellement pendant la maladie. C’est pourquoi la MH est un trouble « neurodégénératif ». En fait, non seulement les cellules cérébrales meurent, mais dans le cerveau, certaines populations de neurones meurent plus tôt et semblent donc plus vulnérables.
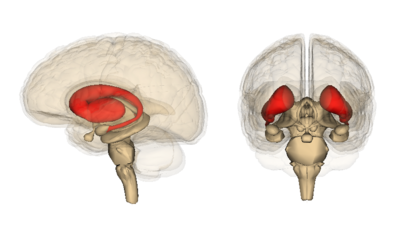
En particulier, la région du cerveau qui présente la mort cellulaire la plus précoce et la plus sévère s’appelle le striatum. Le striatum est situé profondément au centre du cerveau. Son rôle est de coordonner les mouvements volontaires, les pensées et les interactions sociales, et de s’assurer que les choses ne deviennent pas incontrôlables.
Tout, de l’arrêt d’une conversation à l’arrêt d’un mouvement, est couvert par le striatum. Ce qui est extrêmement important, mais pas encore compris, c’est pourquoi cette zone est si sensible à la dégénérescence dans la MH, alors que d’autres régions semblent faire face à la Htt mutée beaucoup plus longtemps avant de mourir.
« Les neurones surchargés de Nrf2 supplémentaire ont éliminé la Htt mutée plus rapidement que la normale et étaient moins susceptibles de mourir. Cela suggère que l’augmentation de la voie de recyclage propre à la cellule pourrait être une cible thérapeutique potentielle dans la MH. »
Sortir les papiers, les déchets et la huntingtine mutée
Deux explications possibles de ces différences ont été explorées par une équipe de recherche dirigée par le Dr Steven Finkbeiner à l’Université de Californie à San Francisco. Une possibilité est qu’il pourrait y avoir une variabilité entre les types de cellules cérébrales dans le taux auquel la Htt mutée forme des structures toxiques. En gros, pour chaque type de cellule, à quelle vitesse les cheveux deviennent-ils des boules de cheveux ?
Une autre explication possible pour la perte sélective de cellules est que différentes régions du cerveau pourraient éliminer et se débarrasser de la Htt mutée différemment. Certaines cellules sont-elles simplement des maniaques de la propreté ?
Les auteurs ont mis au point une technique qui leur permet de mesurer ces propriétés de repliement et d’élimination dans des cellules cérébrales individuelles vivantes en culture. Ils ont rempli les cellules d’une protéine fluorescente appelée « Dendra2 ». Cette protéine est intéressante car elle brille initialement d’une couleur verte (comme un bâton lumineux pour enfants), mais passe à une lumière rouge lorsqu’elle est éclairée avec une couleur spécifique de lumière.
Ainsi, cet outil permet de faire pousser des neurones remplis de dendra2 verte, puis de les illuminer avec une lumière qui transforme la dendra2 en rouge. Observer combien de temps il faut à la cellule pour reconstituer la dendra2 verte et se débarrasser de la dendra2 rouge nous indique à quelle vitesse cette cellule fabrique de nouvelles protéines (vertes) et dégrade les anciennes (rouges).
Crédit image : Life Science Databases
Bien sûr, la dendra2 ne nous intéresse pas vraiment. Ce que nous aimerions vraiment savoir, c’est comment les cellules cérébrales gèrent la protéine MH normale, et si cela est modifié par la mutation qui cause la MH. Pour répondre à cette question, les scientifiques ont utilisé des astuces de laboratoire pour fusionner une protéine MH normale ou mutée à la protéine dendra2. Maintenant, ils pouvaient utiliser le même tour de lumière pour suivre la protéine MH.
L’éboueur peut le faire
En utilisant ce système, ils ont remarqué que la protéine MH mutée était éliminée des neurones du striatum beaucoup plus rapidement que la Htt normale. C’est surprenant – de nombreux scientifiques auraient prédit que la forme mutée de la protéine persisterait plus longtemps, et que cette persistance provoquerait son accumulation en agrégats. Cela suggère que les neurones sont capables de reconnaître la protéine mutée et de la cibler pour l’élimination.
En fait, le microscope automatisé que l’équipe de Finkbeiner a développé leur a permis de voir que plus une cellule individuelle se débarrassait rapidement de la Htt mutée, plus cette cellule vivait longtemps. Cela a du sens – nettoyer les déchets toxiques protège les cellules cérébrales.
Donc, si le système de détection et de confinement des protéines mutées de la cellule fonctionne, où est le problème ? Il s’avère que certains neurones sont meilleurs que d’autres dans cette élimination, notamment ceux du cortex. Le cortex est la région plissée externe du cerveau. Généralement, les cellules du cortex succombent à la MH plus tard que les cellules du striatum. Dans l’espoir de comprendre pourquoi, les auteurs ont comparé l’élimination de la protéine MH mutée dans le striatum avec l’élimination dans le cortex.
« La principale découverte de cette étude est que les neurones de différentes régions cérébrales diffèrent effectivement dans leur susceptibilité à la Htt mutée. Cela pourrait expliquer pourquoi la MH commence à un endroit du cerveau plutôt qu’à un autre. »
En effet, les neurones du cortex étaient capables d’éliminer la Htt mutée plus rapidement. Les neurones du cortex vivaient aussi plus longtemps que les neurones du striatum. Les auteurs ont conclu que cela est dû au fait que ces régions ont des voies de recyclage qui diffèrent dans leurs capacités à éliminer la protéine MH mutée.
Quand les protéines deviennent vieilles ou usées, la cellule dispose d’un système pour les éliminer ou les recycler. Les chercheurs ont exploré si leurs observations pouvaient être expliquées par des effets sur ce système de dégradation. En particulier, ils se sont concentrés sur Nrf2, une protéine qui active la voie de recyclage.
Les scientifiques peuvent étudier comment différents processus cellulaires contribuent à des phénomènes comme la mort cellulaire et le recyclage en augmentant le volume d’un processus particulier, ou en le réduisant. Dans ce cas, parce qu’ils pensaient que les programmes de recyclage activés par la protéine Nrf2 sont importants, ils peuvent donner plus de Nrf2 aux cellules, ou le retirer. Cela les aide à établir si un processus spécifique est important.
C’est exactement ce qu’ils ont fait pour étudier Nrf2 et le recyclage de la protéine MH mutée. Les neurones surchargés de Nrf2 supplémentaire ont éliminé la Htt mutée plus rapidement que la normale et étaient moins susceptibles de mourir. Cela suggère que l’augmentation de la voie de recyclage propre à la cellule pourrait être une cible thérapeutique potentielle dans la MH.
Conformément à cette idée, lorsque les scientifiques ont artificiellement réduit les principales voies de recyclage ou d’élimination des déchets cellulaires avec des médicaments, les cellules étaient moins capables d’éliminer la protéine MH mutée. Cette voie de recyclage spécifique semble donc cruciale pour permettre aux neurones de faire face à cette protéine toxique.

Crédit image : Chris Goodfellow
Qu’est-ce que cela signifie pour la MH ?
La découverte majeure de cette étude est que les neurones de différentes régions cérébrales diffèrent effectivement dans leur susceptibilité à la Htt mutée. Cela pourrait expliquer pourquoi la MH commence à un endroit du cerveau plutôt qu’à un autre. L’astuce intéressante est que cette susceptibilité semble être basée sur les capacités différentes de ces neurones à gérer et éliminer les protéines mutées, plutôt que sur une toxicité intrinsèque de la protéine elle-même.
C’est en fait très important, car la capacité des neurones à gérer la Htt mutée offre une piste intéressante pour des thérapies potentielles. Sur la base des résultats de cette étude, nous pourrions supposer que les traitements augmentant la capacité des neurones à éliminer la Htt mutée aideraient les neurones à vivre plus longtemps.
Cependant, cette possibilité intéressante doit être considérée dans son contexte. Premièrement, toute cette étude a été réalisée en utilisant des neurones cultivés en laboratoire. Il reste à voir si ce phénomène sera également observé dans la maladie humaine, ce qui est le plus important.
Deuxièmement, ces découvertes sont préliminaires, car les thérapies possibles décrites ci-dessus n’existent pas encore. Il faudra du temps pour concevoir quelque chose d’approprié et le tester dans d’autres modèles de MH avant de pouvoir l’essayer chez l’humain. Par exemple, personne ne sait quels effets secondaires néfastes pourraient survenir si la voie Nrf2 était artificiellement augmentée pendant une longue période.
En conclusion, ces observations constituent une science fondamentale très intéressante sur la MH. Et bien qu’il n’y ait toujours pas de médicaments approuvés qui s’attaquent au problème sous-jacent dans la MH, des études comme celle-ci fournissent une meilleure compréhension de cette terrible maladie et aident à ouvrir la voie au développement de nouveaux médicaments.
En savoir plus
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…