Conférence thérapeutique sur la maladie de Huntington 2019 – jour 2
Nouveaux outils pour combler le fossé entre le laboratoire et les patients dans notre compte-rendu du deuxième jour de la conférence thérapeutique MH 2019

Jeff et Ed rendent compte de la conférence thérapeutique portant sur la maladie de Huntington – le plus grand rassemblement annuel de chercheurs MH. La conférence de cette année est plus importante et plus passionnante que jamais.
Sur le premier jour ici
Outils de pointe pour la recherche translationnelle
Bonjour tout le monde ! Le deuxième jour de la conférence thérapeutique MH 2019. La première session porte sur « les outils de pointe pour la recherche translationnelle.
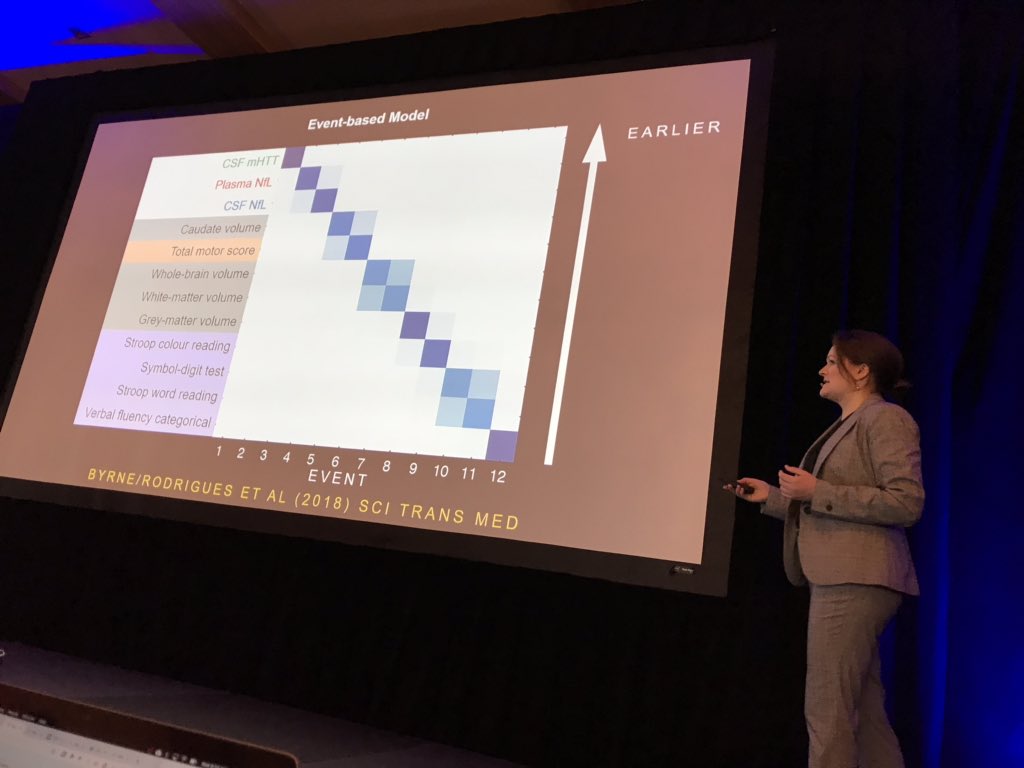
Le premier intervenant aujourd’hui est Lauren Byrne de UCL, laquelle étudie les biomarqueurs dans le sang et le liquide céphalorachidien. Byrne mesure la Huntingtine dans le liquide céphalorachidien et la protéine neurofilament à chaîne légère dans celui-ci et le sang de 80 volontaires. Le neurofilament à chaîne légère ou NF-L est une protéine présente dans les neurones et libérée lorsque ceux-ci sont endommagés. Byrne a donc réalisé des scans IRM pour voir comment chaque biomarqueur prédit l’atrophie du cerveau. De manière surprenante, le neurofilament s’avère être un meilleur prédicteur des symptômes cliniques de la protéine huntingtine mutante et du volume du cerveau. Les modifications de ces marqueurs "biofluidiques » ont également été parmi les toutes premières modifications détectables, précédant les mesures d’imagerie et cliniques dans la séquence des événements de la maladie de Huntington.
Byrne a, actuellement, terminé le suivi, d’une durée de deux ans, de l’étude HD-CSF et a constaté que le neurofilament à chaîne légère semble évoluer comme prévu avec le temps, et peut être mesuré à l’aide d’un nouveau système qui teste quatre molécules à la fois.
L’intervenant suivant est Amber Southwell de UCF qui s’intéresse également au développement d’outils afin de quantifier la huntingtine dans le liquide céphalorachidien. L’équipe de Southwell est la première équipe à montrer que lorsque les souris sont traitées à l’aide d’une thérapie de diminution de la huntingtine – en particulier avec un ASO de la société Ionis Pharma – les taux de la huntingtine mutante dans le liquide céphalorachidien sont réduits. C’est important ; cela signifie que lorsque nous traitons des patients MH avec des médicaments de diminution de la huntingtine, nous prédirions que les taux de la huntingtine mutante dans le liquide céphalorachidien vont diminuer. C’est l’une des choses que les chercheurs veulent dire lorsqu’ils disent qu’une mesure est un « biomarqueur ».
L’équipe de Southwell effectue une série d’expériences intéressantes avec des souris dépourvues de huntingtine dans certains types spécifiques de cellules cérébrales. Cela lui permet de cartographier un type exact de cellule cérébrale responsable de la libération de huntingtine mutante dans le liquide céphalorachidien. Elle mène également une autre série d’expériences axées sur la compréhension du processus exact par lequel la huntingtine mutante passe des cellules cérébrales appelées neurones au liquide céphalorachidien. Un processus de nettoyage du cerveau, appelé « clairance glymphatique » semble susceptible de jouer un rôle dans la protéine huntingtine mutante qui pénètre dans le liquide céphalorachidien.
Prochain intervenant, David Salzman de sRNAlytics, une compagnie qui étudie l’utilisation de l’ARN dans l’étude de maladies. L’ARN est le cousin simple brin de l’ADN. Les cellules utilisent l’ARN pour de nombreuses fonctions, la plus connue en tant celle de la « copie de travail » des gènes qu’elles veulent activer. C’est ce qu’on appelle l’ARN messager. Moins connu, les cellules produisent de nombreuses petites molécules ARN qui sont utiles à la régulation de l’activation des gènes. Elles ont pour nom microARN et il en existe différentes. Nous comprenons très bien les gènes en tant que recettes des protéines, mais les micro-ARN sont pour le moment beaucoup plus mystérieux.

SRNAlytics identifie des shémas de modifications des petits ARN et utilise des algorithmes d’intelligence artificielle pour identifier de quelle partie du corps ils proviennent et comment ils se modifient en fonction de différentes maladies. Un panel de 60 petits ARNs dans le liquide céphalorachidien peut apparemment faire la distinction entre les maladies de Huntington, d’Alzheimer et de Parkinson avec une bonne précision. Deux petits ARNs présentent un intérêt particulier dans la MH, mais il est important de comprendre exactement ce qu’ils font dans les cerveaux sains et dans les cerveaux MH afin de déterminer leur valeur en tant qu’éventuels biomarqueurs.
De nouveaux modèles animaux
Guoping Feng, de MIT, est le prochain intervenant. Son laboratoire travaille sur le développement de nouveaux modèles primates MH. Il indique que les souris sont très utiles mais elles ne possèdent pas toutes les mêmes régions cérébrales que l’être humain, et en conséquence, il est nécessaire d’étudier des cerveaux bien plus sophistiqués. Il était difficile, voire impossible, de modifier génétiquement des primates, tels que les singes, mais les nouveaux outils d’édition du génome rendent cela possible. Des outils, tels que CRISPR/Cas9, permettent de modifier de manière précise l’ADN pour produire de l’ADN d’embryons de singe. Le laboratoire de Feng est l’un des meilleurs au monde pour apporter des modifications à l’ADN des primates. Il décrit qu’ils ont appris des FIV cliniques humaines les meilleures façons de garder les embryons de primates en bonne santé. Le laboratoire de Feng a généré un nouveau modèle de singe portant une forme génétique d’autisme. Ces singes ont des comportements très intéressants qui ressemblent vraiment à ceux des humains atteints d’autisme, en ce compris des comportements sociaux altérés. Il travaille actuellement sur le développement d’un modèle de singe MH et a mené des premières expériences suggérant que cela devrait être possible.
Hideyuki Okano, de l’Université de Keio, travaille également sur des modèles primates de maladies humaines, en particulier les ouistitis. Son laboratoire a modifié génétiquement des ouistitis afin qu’ils développent une forme de la maladie de Parkinson causée par une mutation génétique. Ces animaux présentent des symptômes très proches de ceux observés chez des patients atteints de la maladie de Parkinson, notamment un état de sommeil très difficile appelé trouble du comportement du sommeil paradoxal (RBD). Ceux-ci ont également des tremblements et des problèmes de marche qui ressemblent à ceux des patients atteints de la maladie de Parkinson. C’est un bon argument pour utiliser des animaux plus sophistiqués afin de modéliser des maladies cérébrales progressives. Le laboratoire Okano développe actuellement des techniques permettant de générer des modèles similaires pour la maladie de Huntington.
C’est tout pour aujourd’hui ! Assurez-vous de consulter notre article du premier jour ici et soyez prêts demain pour notre dernier compte-rendu.
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…