Double succès pour le silençage génique de la huntingtine par ARNi
2 bonnes nouvelles pour le silençage génique par ARNi dans la MH : il est sûr sur six mois, et une façon de traiter de plus grandes zones du cerveau

La plupart des chercheurs sur la MH sont assez enthousiastes à l’idée de ‘faire taire’ le gène de la maladie de Huntington, pour réduire la production de la protéine huntingtine nocive. Deux défis – la sécurité et l’administration – sont maintenant plus près d’être résolus grâce au travail collaboratif des chercheurs universitaires et industriels.
Nous sommes de grands fans du silençage génique. Comme beaucoup de chercheurs sur la maladie de Huntington, nous pensons que c’est l’approche la plus susceptible de produire un traitement efficace pour la MH.
Le silençage génique implique l’utilisation d’un médicament spécialement conçu pour intercepter une molécule messagère, appelée ARN, qui est produite à partir du gène MH et qui dit aux cellules de fabriquer la protéine huntingtine nocive. L’effet du médicament est que les cellules produisent moins de protéines.
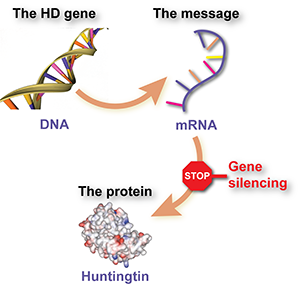
Dit encore plus simplement, le silençage génique est comme un panneau stop pour la huntingtine mutante.
Progrès rapides
Jusqu’à présent, le silençage génique pour la MH, sous diverses formes, a franchi tous les obstacles rencontrés. Il a maintenant été testé sur plusieurs modèles de souris et de rats de la MH, et a non seulement ralenti la progression mais a réellement produit une amélioration des symptômes et des dommages cérébraux. Il semble que le cerveau puisse réellement récupérer – dans une certaine mesure – si seulement les niveaux de la protéine nocive peuvent être un peu abaissés.
Les obstacles restants
Plusieurs équipes de recherche se dirigent vers des essais humains de silençage génique dans la MH. Mais il reste quelques défis à relever avant que cela ne puisse se produire.
Le premier est la sécurité. Des effets secondaires inattendus sont toujours possibles, et pourraient être dramatiques, puisque nous parlons de médicaments qui sont injectés ou perfusés directement dans le système nerveux, et interagissent directement avec la machinerie génétique de nos cellules.
Un autre est l’administration. Les médicaments de silençage génique ne peuvent pas être donnés sous forme de pilules ou d’injections dans le sang, car ils ne seraient pas admis dans le cerveau. Ils doivent donc être introduits directement dans le système nerveux. Selon la structure du médicament, cela signifie une opération pour introduire des aiguilles ou des tubes dans la colonne vertébrale ou le crâne. Cela semble drastique, mais si le traitement est efficace, cela en vaudra la peine.
Le problème de l’administration ne s’arrête pas là cependant, car une fois que le médicament est dans la tête, il doit pénétrer à l’intérieur de nos cellules cérébrales pour exercer sa magie génétique.
Le menu du silençage génique
Les chercheurs en silençage génique doivent faire plusieurs choix avant de commencer un essai de traitement. Voici une liste de contrôle pour t’aider à comprendre les futures actualités.
Premièrement, nous devons décider de la structure du médicament. Les deux choix de base sont les médicaments ARNi, qui sont chimiquement similaires aux molécules d’ARN messagères du corps ; et les médicaments ASO, qui sont légèrement différents mais peuvent être mieux absorbés par les cellules.
Le deuxième choix est la cible à choisir : les deux copies du gène MH, ou seulement celle qui est mutante. Cibler les deux – appelé
Le troisième choix est la destination – où ira le médicament ? Les médicaments ARNi ne se propagent pas naturellement loin, donc le médicament doit être administré directement dans la substance du cerveau. Les médicaments qui se propagent plus loin, comme les ASO, pourraient être perfusés dans le liquide autour du cerveau ou, si nous avons de la chance, à la base de la colonne vertébrale.
Quatrièmement, nous devons décider de l’administration. Le médicament sera-t-il administré seul, emballé dans un virus ou pompé sous pression, pour augmenter sa propagation dans le cerveau ?
Le cinquième choix est le régime de traitement. Devrions-nous donner un traitement unique ou perfuser le médicament pendant des semaines ou des mois ? Pour l’instant, nous ne savons pas combien de temps les effets dureront, donc cela doit être déterminé en comparant différents régimes.
Chaque fois que tu lis sur la recherche en silençage génique, il est utile de déterminer d’emblée quelle option a été sélectionnée pour chacun de ces choix.
Trois arrivent en même temps
Lors du récent Congrès mondial sur la MH à Melbourne, HDBuzz a rapporté des présentations passionnantes de plusieurs groupes de recherche sur le silençage génique. Puis en novembre, nous t’avons apporté des nouvelles du premier essai de sécurité du silençage génique de la huntingtine utilisant l’ARNi dans un cerveau de primate.
« Le médicament ARNi s’est propagé plus loin que ce qu’on obtiendrait avec de simples injections. Beaucoup plus loin, en fait. »
Maintenant, deux autres articles scientifiques ont été publiés – chacun étant le fruit d’une collaboration entre des chercheurs universitaires et des entreprises de biotechnologie. Les deux articles impliquaient l’entreprise Medtronic basée à Minneapolis et l’équipe du Dr Zheming Zhang de l’Université du Kentucky.
Sécurité sur six mois
Le rapport de novembre sur la sécurité de l’ARNi chez les primates était une étude assez courte – six semaines. La nouvelle étude de Medtronic et de l’équipe de Zhang, rapportée dans la revue Brain, a également été réalisée sur des singes rhésus, mais a duré six mois complets.
Examinons ce que les chercheurs ont étudié, en utilisant la liste de contrôle ci-dessus :
-
Structure : il s’agissait d’un essai d’un médicament ARNi.
-
Cible : les deux copies du gène ont été ciblées – inhibition non spécifique.
-
Destination : la substance du cerveau – le striatum, pour être exact, qui est affecté tôt chez les patients MH.
-
Administration : le médicament a été emballé dans un virus vide, appelé AAV2.
-
Régime de traitement : une injection unique dans cinq sites de chaque côté du cerveau
Il est également important de noter que des singes ‘normaux’ ont été utilisés, sans copies étendues du gène MH. Donc, cet essai ne pouvait mesurer que les changements de protéines et la sécurité – il ne peut pas prédire l’amélioration chez les patients.
Après le traitement, les singes ont été observés pendant six mois, en examinant leur santé générale et leur contrôle des mouvements. La chirurgie a été bien tolérée, et aucun nouveau problème n’a été observé chez les animaux traités.
Comme espéré, les niveaux de protéine huntingtine ont significativement diminué dans les régions traitées. À chaque site d’injection, les niveaux de protéines ont été réduits sur une zone d’environ six millimètres de diamètre – en volume, c’est environ l’équivalent de trois M&M’s par cerveau. Cela peut ne pas sembler beaucoup, mais dans un cerveau humain, cela pourrait faire une grande différence, et rappelle-toi que ces mesures ont été faites 6 mois après le traitement unique.
Heureusement, le médicament n’a causé aucun changement cérébral nocif comme l’inflammation, l’infection ou les dommages neuronaux.
Donc, le médicament a fait son travail de réduction des niveaux de protéines, et le traitement ne semble pas avoir produit d’effets nocifs. Les auteurs estiment que six mois de singe équivalent à environ 18 mois humains. Ça semble bon – mais comme le soulignent les auteurs, cela pourrait prendre encore plus de temps chez les humains pour que des effets bons ou mauvais apparaissent.
Une méthode d’administration innovante
L’autre nouvel article provient d’une collaboration tripartite entre l’équipe de l’Université du Kentucky, Medtronic et l’entreprise de médicaments ARNi Alnylam Pharmaceuticals. Il a été publié dans la revue Experimental Neurology.
Il s’agissait également d’une étude d’inhibition non spécifique par ARNi, administrée dans le striatum de singes.
Ce qui distingue ce travail est la méthode d’administration innovante. Une technique appelée administration améliorée par convection (CED) a été utilisée. Cela implique de placer des tubes à travers le crâne et dans la substance du cerveau. L’extrémité supérieure du tube est connectée à une petite pompe qui injecte constamment le médicament dans le tube sous pression. Cette pression est la clé – elle fait que la molécule du médicament se propage beaucoup plus loin qu’elle ne le ferait autrement.

La CED est déjà utilisée pour faire se propager davantage les médicaments de chimiothérapie dans les tumeurs cérébrales. Mais cela fonctionnerait-il pour administrer un médicament ARNi ?
D’abord, le médicament a été pompé dans le cerveau pendant sept jours. Seul un côté du cerveau a été traité, afin que l’autre puisse être utilisé pour comparaison. Une gamme de doses et de taux de perfusion a été utilisée, pour trouver la meilleure combinaison. Ensuite, une perfusion de 28 jours a été essayée. Astucieusement, l’équipe a apporté des modifications radioactives inoffensives au médicament, ce qui leur a permis de mesurer exactement jusqu’où il s’était propagé.
Le médicament a fait son travail de réduction des niveaux de huntingtine, et les tubes et perfusions n’ont pas particulièrement endommagé le cerveau.
Mais est-ce que le tracas supplémentaire de l’installation des tubes et des pompes en valait la peine – le médicament s’est-il propagé plus loin ? En bref, oui.
Les mesures ont montré que le médicament ARNi a atteint beaucoup plus loin que ce qu’on attendrait avec de simples injections. Si les deux côtés du cerveau avaient été traités, les niveaux de huntingtine auraient été réduits dans l’équivalent d’environ onze M&M’s de cerveau.
En résumé…
Avant la publication de ces deux articles, nous savions déjà que la huntingtine pouvait être réduite dans le cerveau de singe en utilisant l’ARNi. Maintenant, nous pouvons ajouter deux coches majeures à notre liste de souhaits : premièrement, le silençage fonctionne et est sûr sur de plus longues périodes, et deuxièmement, il existe des moyens de faire se propager le médicament plus loin.
Que pourrait-il se passer de mal ?
Un optimisme prudent est une approche sage ici. Il y a certainement des choses qui pourraient mal se passer sur le chemin des essais humains, ou pendant ceux-ci.
Ces essais sur les primates ont montré que la réduction des niveaux de huntingtine est sûre chez les singes en bonne santé. Mais cela ne signifie pas que c’est définitivement sûr chez les patients humains. Les cerveaux humains sont beaucoup plus grands et plus complexes que les cerveaux de singes. Donc le traitement pourrait être moins efficace, ou plus dangereux, simplement à cause de la différence d’espèce.
Il est également possible que la protéine saine protège en quelque sorte le cerveau de son frère nuisible chez l’homme. Si c’est le cas, le fait de faire taire les deux copies pourrait, de manière inattendue, faire plus de mal que de bien.
Le cerveau des personnes présentant des symptômes de la maladie de Huntington est probablement plus fragile et plus difficile à opérer. Les parties du cerveau qui doivent être traitées sont plus petites que la normale, en raison du rétrécissement causé par la maladie de Huntington. Les opérations peuvent donc être plus difficiles et plus risquées.
Enfin, il pourrait être difficile de détecter le succès chez l’homme, car la maladie progresse lentement et nous ne pouvons pas examiner le cerveau des patients au microscope.
Mais n’oubliez jamais que tous ces problèmes sont étudiés conjointement par certains des meilleurs esprits scientifiques du monde, tous concentrés sur la concrétisation de traitements efficaces pour les patients.
2012 – l’année du silençage génique pour la maladie de Huntington ?
2012 pourrait-elle être l’année du silençage génique pour les patients atteints de la maladie de Huntington ? Allons-nous assister à un ou plusieurs essais sur l’homme dans les mois à venir ? Forts des progrès réalisés jusqu’à présent, nous pensons qu’il est raisonnable de l’espérer, et plusieurs groupes travaillent d’arrache-pied pour en faire une réalité. Les premiers essais seront de petite envergure et seront menés lentement et avec une grande prudence, car la sécurité est la principale préoccupation. Mais si tout se passe bien, des essais plus importants suivront.
En savoir plus
- Article sur le cerveau concernant un traitement par ARNsi de 6 mois par Grondin et ses collègues (accès libre)
- Article de Experimental Neurology sur l’administration d’ARNsi par perfusion améliorée par convection par Stiles et ses collègues (l’article complet nécessite un paiement ou un abonnement)
- Notre article sur l’essai de sécurité précédent sur les primates par le Dr Beverly Davidson
Sources et références
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…