Calmer le système immunitaire aide les souris atteintes de la maladie de Huntington
Un médicament activant CB2 améliore la survie et les symptômes chez les souris atteintes de la maladie de Huntington en calmant le système immunitaire

Le système immunitaire semble se comporter anormalement dans la maladie de Huntington. Maintenant, un médicament qui active les récepteurs CB2 sur les cellules immunitaires s’est révélé améliorer les symptômes et la survie chez les souris HD – avec des implications intéressantes pour le système immunitaire comme cible pour les thérapies HD.
Le système immunitaire dans la HD
La maladie de Huntington est appelée une maladie neurodégénérative, car la plupart des symptômes sont causés par le dysfonctionnement et la mort des neurones. Mais la protéine huntingtine mutante qui cause la HD est produite par chaque cellule du corps, et ces dernières années, les chercheurs ont regardé au-delà du cerveau dans la recherche de traitements pour la HD.
Crédit image : Society for Neuroscience (Bouchard et al.)
Une découverte qui a émergé de cette approche corps entier est que le système immunitaire – notre défense contre l’infection et les blessures – semble se comporter légèrement différemment chez les patients HD.
En moyenne, les niveaux de substances chimiques de signalisation immunitaire appelées cytokines sont plus élevés que la normale chez les personnes avec la mutation de la maladie de Huntington, même avant que les symptômes ne commencent. Et les globules blancs des patients HD sont hyperactifs – quand ils sont cultivés en laboratoire et stimulés avec des substances chimiques de bactéries, ils produisent plus de cytokines que la normale.
Les liens entre le gène HD, le comportement du système immunitaire et le cerveau sont encore en cours d’élucidation. Mais il y a déjà des signes qu’altérer artificiellement le système immunitaire pourrait être une façon de combattre la HD.
L’année dernière, un groupe de chercheurs dirigé par le Dr Paul Muchowski au Gladstone Institute of Neurological Disease en Californie a montré qu’altérer le comportement chimique des globules blancs, en utilisant un médicament appelé JM6, faisait vivre plus longtemps les souris HD. Et plus tôt cette année, l’équipe de Muchowski a rapporté que transplanter de la moelle osseuse de souris ‘normales’ dans des souris HD était légèrement bénéfique.
Donc, étudier le système immunitaire pour comprendre la HD, et comme cible pour d’éventuels traitements, est un sujet assez brûlant en ce moment. Et avec un nouvel article dans le Journal of Neuroscience, l’équipe de Muchowski l’a fait encore – cette fois avec une étude remarquable centrée sur l’activité des ‘récepteurs CB2’ dans le système immunitaire.
Les récepteurs CB2 ?
Un récepteur est une molécule qui dépasse d’une cellule, attendant qu’une substance chimique de signalisation l’atteigne. Quand cela arrive, le récepteur déclenche une série d’événements chimiques à l’intérieur de la cellule, changeant finalement le comportement de la cellule.
Chaque récepteur n’est capable d’« attraper » qu’un type particulier de substance chimique de signalisation, et chaque récepteur cause sa propre série d’événements dans la cellule. C’est ainsi que chaque cellule de notre corps est capable de répondre de manière appropriée à une variété de signaux.
Les récepteurs CB2 font partie de la famille des récepteurs ‘cannabinoïdes’. Ils sont appelés ainsi parce qu’ils peuvent être déclenchés par les substances chimiques du cannabis. Mais – juste pour que ce soit clair – ce n’est pas une étude sur le cannabis !
Une chose intéressante à propos des récepteurs CB2 est qu’ils se trouvent principalement sur les cellules du système immunitaire. Activer les récepteurs CB2 ‘calme’ ces cellules immunitaires, les amenant à produire moins de leurs propres substances chimiques de signalisation – les cytokines que nous avons mentionnées plus tôt.
Sachant cela, et sachant que le système immunitaire est hyperactif dans la maladie de Huntington, activer les récepteurs CB2 devrait être une bonne chose. En regardant dans l’autre sens, désactiver les récepteurs CB2 pourrait être mauvais dans la HD. L’équipe de Muchowski a examiné les deux possibilités, en commençant par la seconde.
Éliminer le gène CB2
L’équipe a commencé avec des animaux modèles de la maladie de Huntington appelés souris BACHD, qui produisent la protéine huntingtine mutante humaine et développent des symptômes similaires à la HD. Les symptômes chez les souris BACHD commencent vers six mois et progressent lentement.
Ils ont ensuite utilisé l’ingénierie génétique pour créer des souris BACHD qui n’ont pas le gène qui produit le récepteur CB2. Retirer un gène de cette façon s’appelle un ‘knockout’ génétique.
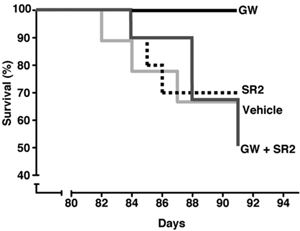
« Quand l’essai a été arrêté après treize semaines, 30 % des souris non traitées étaient mortes. Mais aucune des souris traitées avec GW n’est morte. »
Les souris BACHD sans récepteurs CB2 ont développé des symptômes beaucoup plus rapidement que les souris BACHD normales – vers trois mois au lieu de six.
Pour vérifier que l’apparition plus précoce n’était pas juste parce que manquer CB2 est mauvais pour les cerveaux, l’équipe de Muchowski a regardé un troisième groupe de souris. Celles-ci manquaient de CB2 mais ne produisaient pas d’huntingtine mutante. Ces souris semblaient normales. Ce n’est que quand les deux anomalies génétiques étaient présentes – produire de l’huntingtine mutante et manquer CB2 – que les souris ont eu des symptômes très rapidement progressifs.
Et ce n’étaient pas seulement les symptômes qui étaient pires chez ces souris. Les chercheurs ont regardé les niveaux d’une protéine appelée synaptophysine dans leurs cerveaux. La synaptophysine est essentielle pour les connexions entre neurones, et il y en avait beaucoup moins dans les cerveaux des souris BACHD qui n’avaient pas de récepteurs CB2.
Activer CB2 avec un médicament : GW
Avec les résultats du knockout CB2 suggérant que les récepteurs CB2 font quelque chose pour aider à maintenir les symptômes à distance dans la maladie de Huntington, l’équipe de Muchowski a pris l’étape suivante en tentant d’augmenter l’activité des récepteurs CB2. Pour faire cela, ils ont utilisé un médicament activant CB2 appelé GW405833, ou GW en abrégé.
Pour tester si activer les récepteurs CB2 avec GW est utile, les chercheurs ont utilisé des souris modèles de la maladie de Huntington appelées souris R6/2. Ces souris développent des symptômes très jeunes et tombent malades rapidement.
GW a été régulièrement injecté dans les souris R6/2 peu après que les symptômes aient commencé, à partir de quatre semaines d’âge. Leurs symptômes de mouvement ont été testés en mesurant leur capacité à garder l’équilibre. Les souris traitées avec GW ont fait mieux que les souris non traitées – elles ont pu garder l’équilibre sur un poteau rotatif pendant presque deux fois plus longtemps.
Les souris R6/2 meurent habituellement après environ cinq mois, mais le traitement GW a produit quelque chose d’assez dramatique. Quand l’essai a été arrêté après treize semaines, 30 % des souris non traitées étaient mortes. Mais aucune des souris traitées avec GW n’est morte. Bien sûr, nous ne savons pas combien de temps elles auraient vécu après l’essai, mais peu importe comment tu regardes ça, c’est frappant.
Après, l’équipe de Muchowski a mesuré les niveaux de synaptophysine dans le cerveau. Rappelle-toi que ceux-ci avaient été plus bas chez les souris knockout CB2. Chez les souris traitées avec GW, les niveaux de synaptophysine étaient plus élevés, suggérant qu’un effet bénéfique de GW est d’améliorer les connexions entre neurones.
Avec de si bons résultats du traitement précoce, les chercheurs ont répété l’essai, commençant le traitement un mois plus tard à huit semaines d’âge. À ce moment-là, les souris étaient déjà assez malades. Mais le médicament était encore bénéfique pour les problèmes de mouvement et les connexions cérébrales.
Sang ou cerveau ?
Les récepteurs CB2 se trouvent principalement sur les cellules immunitaires, qui à leur tour se trouvent principalement dans le sang, la moelle osseuse et la rate. Le cerveau a ses propres cellules immunitaires, appelées microglie. Donc il est important de demander quelles cellules GW traite réellement. Est-ce qu’il améliore les symptômes à travers la microglie dans le cerveau, ou les globules blancs dans le corps ?
L’équipe de Muchowski a utilisé une astuce intelligente pour le découvrir. Certaines souris R6/2 ont reçu deux médicaments. L’un était GW ; l’autre était un ‘antagoniste’ CB2 appelé SR2. Un antagoniste est un médicament qui
Ça ne semble pas terriblement intelligent, jusqu’à ce que tu apprennes que les médicaments atteignent différents endroits dans le corps. GW va partout – le sang, les organes et le cerveau. Mais SR2 n’atteint pas le cerveau – il reste dans le sang et les organes. Donc parce que SR2 neutralise l’effet de GW dans le corps, les souris traitées avec les deux médicaments obtiennent juste les effets de GW dans le cerveau.

Si GW fonctionne dans le cerveau, tu t’attendrais à ce que les animaux doublement traités s’améliorent – mais ils ne l’ont pas fait. Ils sont tombés malades et sont morts comme les souris non traitées. Cela suggère que les bénéfices de GW viennent de ses effets sur les cellules immunitaires à l’extérieur du cerveau.
Quelque chose de similaire avait été vu pour l’autre médicament de Muchowski, JM6. Ensemble, ces résultats suggèrent que changer le comportement du système immunitaire dans le corps peut avoir des effets bénéfiques pour le cerveau, ouvrant beaucoup de nouvelles lignes d’attaque dans la lutte contre la maladie de Huntington.
Aller plus loin
Comment GW fonctionnant sur les cellules immunitaires pourrait-il bénéficier au cerveau ? Une possibilité est à travers l’action des cytokines – ces molécules de signalisation immunitaire que nous avons mentionnées plus tôt. Rappelle-toi que les échantillons de sang des patients atteints de la maladie de Huntington ont des niveaux plus élevés de ces cytokines, particulièrement une appelée IL-6.
Quand l’équipe de Muchowski a mesuré les niveaux d’IL-6 chez les souris traitées avec GW, ils ont trouvé qu’ils étaient plus bas – effectivement, le GW avait ‘calmé’ le système immunitaire hyperactif. Donc ces scientifiques travailleurs ont mené un autre essai de médicament pour investiguer IL-6 plus loin.
Cette fois, ils ont donné aux souris R6/2 des injections d’une protéine d’anticorps qui se colle à IL-6 et dit au corps de l’enlever. Les souris traitées avec cet anticorps réduisant IL-6 avaient un meilleur contrôle du mouvement que les souris non traitées. L’effet n’était pas aussi dramatique que ce qui avait été vu avec GW, mais il était là, suggérant que la réduction d’IL-6 pourrait être une façon dont les bénéfices de GW atteignent le cerveau.
Résumé
Cette étude, représentant des années de travail, nous donne beaucoup de matière à réflexion.
Nous savions déjà que le système immunitaire se comporte quelque peu différemment dans la HD, mais nous étions moins clairs sur le fait que le traiter directement était une bonne idée.
L’étude de Muchowski fournit des preuves solides que les récepteurs CB2 sont un lien important entre le système immunitaire dans le corps, et la maladie de Huntington dans le cerveau.
Le médicament GW a produit des bénéfices assez dramatiques pour ces souris R6/2 très malades, mais GW n’a jamais été testé chez les humains, donc beaucoup de tests de sécurité seront nécessaires pour s’assurer qu’il n’est pas nocif. Les médicaments qui activent les récepteurs CB sont autorisés dans certains pays (par exemple, Sativex pour les symptômes de la sclérose en plaques), mais il n’y a pas d’activateur CB2 spécifique sur le marché.
Il vaut aussi la peine de se rappeler que d’autres médicaments qui ont amélioré la souris R6/2 n’ont pas été jusqu’à présent réussis quand testés chez les humains, parce qu’aucun animal n’est un modèle parfait de la maladie de Huntington.
Un angle intéressant de cette recherche est le bénéfice léger de l’anticorps IL-6. Fait intéressant, un tel médicament est déjà autorisé pour l’usage humain dans l’arthrite – il s’appelle tocilizumab (ou Actemra). Un essai humain de ce médicament dans la maladie de Huntington est une possibilité, et serait probablement plus rapide à démarrer qu’un essai de GW.
Finalement – parce que nous savons que tu te demandes encore – cette étude ne peut rien nous dire d’utile sur le fait que le cannabis soit utile pour les patients atteints de la maladie de Huntington. Bien que le cannabis contienne des molécules activant CB2, il contient des centaines d’autres substances chimiques, dont beaucoup ont d’autres effets biologiques, qui n’ont pas été testés dans la HD. Donc bien que nous sachions que le cannabis est populaire dans la HD et au-delà, nous ne pouvons pas lui donner un sceau d’approbation scientifique basé sur cette étude.
En savoir plus
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…


