
Conférence thérapeutique sur la maladie de Huntington 2016 – 3ème jour
Cellules souches et modélisation de la M.H. dans notre dernier compte-rendu sur la conférence thérapeutique.

Le troisième et dernier jour de la conférence thérapeutique 2016 fait le point sur les thérapies de remplacement cellulaire, en ce y compris les cellules souches, et sur de nouvelles façons d’évaluer et de modéliser la progression de la maladie de Huntington pour une meilleure compréhension et la réalisation d’essais cliniques importants.
Jeudi matin : remplacement des cellules, restauration des réseaux.
La journée à Palm Springs débute avec une séance sur une idée folle qui nous permettrait de remplacer les cellules du cerveau.
Ali Brivanlou est un ‘biologiste du développement’, scientifique qui étudie le processus par lequel un ovule fécondé arrive à maturité. Son laboratoire utilise des cellules souches embryonnaires pour étudier le développement humain. Ces cellules ont la capacité unique de se développer dans tout type de cellule : cellules du cerveau, cellules musculaires, etc… Brivanlou est fasciné par le processus qu’utilisent les premières cellules embryonnaires pour prendre des décisions concernant le type de cellules qu’elles vont devenir.
Son laboratoire a utilisé CRISPR/Cas9 (la technique de correction de l’ADN évoqué hier) pour produire la mutation MH dans des cellules souches embryonnaires. Il peut donc maintenant comparer, très précisément, l’impact de la mutation MH sur les processus de développement auxquels il s’intéresse. Pourquoi se soucier de cela, les personnes ayant la mutation MH ne se développent-elles pas plus ou moins normalement ? Oui, mais on aimerait mieux comprendre ce que la protéine huntingtine fait. Lorsqu’on supprime le gène MH chez des souris, elles meurent avant leur naissance. La protéine huntingtine normale fait donc quelque chose d’essentiel lors du processus de développement de l’œuf fécondé en bébé en bonne santé. Mieux comprendre ce rôle peut être utile pour comprendre ce qui ne va pas lorsque la protéine huntingtine est mutée. Brivanlou rappelle : « un humain n’est pas une souris ! ». L’étude des cellules humaines est nécessaire pour comprendre la MH humaine. Brivanlou a constaté que la mutation du gène MH est responsable de changements spécifiques dans les signaux qui indiquent aux cellules embryonnaires en pleine croissance ce qu’elles vont devenir.
Gerardo Morfini étudie les problèmes de communication qui apparaissent dans les cerveaux humains avant la mort des cellules du cerveau, lesquelles ont des problèmes pour se « parler ». La tâche principale des neurones (ces cellules qui meurent le plus dans les cerveaux MH) est d’envoyer des signaux entre eux. Ces signaux parcourent de longues branches que les scientifiques appellent des ‘axones’, une partie des neurones à laquelle Morfini s’est intéressé dans le cadre de la MH. Le rétrécissement, ou la rétractation, des axones est à l’origine de nombreuses maladies du cerveau. Lorsque les axones meurent, les messages ne peuvent plus être envoyés à d’autres cellules.
Morfini, ainsi que d’autres chercheurs, ont observé que la protéine huntingtine mutante ralentit le trafic de substances essentielles en aval et en amont des axones. Les axones peuvent être longs ; l’axone du nerf sciatique va du bas du dos jusque à la pointe du pied ! Morfini a découvert qu’un changement induit par la protéine huntingtine mutante nuit aux moteurs transportant des substances en aval et en amont des axones. Lorsqu’il corrige ce problème, les souris MH se portent mieux, ce qui suggère qu’il existe peut-être un nouveau moyen pour tenter de combattre les problèmes de communication du cerveau dans le cadre de la MH. Morfini essaie maintenant d’identifier des médicaments qui pourraient atteindre les mêmes avantages.
Un grand nombre de neurones, de type différent, travaillent ensemble pour faire fonctionner le cerveau via des circuits qui sous-tendent le comportement. Paola Arlotta veut comprendre comment, dans le cerveau, chaque neurone décide le type de neurone nécessaire pour faire fonctionner les circuits. Son laboratoire a développé des techniques leur permettant de décomposer des cerveaux intacts et d’isoler chacun des neurones composant le circuit. Normalement, les neurones décident du type de fonctions nécessaires pour mener à bien le développement précoce du cerveau, avant notre naissance.
Arlotta est intéressée par l’idée fascinante selon laquelle on pourrait être en mesure de forcer les neurones d’un cerveau adulte à devenir d’autres types de neurones. Elle a montré que cela est possible, en lui permettant de reprogrammer des circuits dans le cerveau adulte d’une façon qu’on ne croyait pas possible auparavant.
Ann Graybiel (MIT) est parmi l’un des plus grands experts au monde en noyaux gris centraux (ou ganglions de la base, une partie du cerveau). Les noyaux gris centraux revêtent une importance dans le cadre de la maladie de Huntington car ils sont la partie du cerveau la plus vulnérable dans le cadre de cette maladie. La tâche la plus évidente des noyaux gris centraux est d’aider à réguler le mouvement (c’est pourquoi les patients MH ont des problèmes moteurs particuliers). Mais les scientifiques se rendent de plus en plus compte que ces parties du cerveau jouent également un rôle important dans la régulation de l’humeur et des émotions.
Graybiel s’est intéressée au fait de savoir si, dans le cadre de la MH, les problèmes émotionnels, tels que la dépression, pourraient être dus au dysfonctionnement des noyaux gris centraux. Elle étudie ces circuits dans des cerveaux de singe qui ressemblent plus à ceux des humains, contrairement à ceux des souris ou des mouches à fruits. Ils ont identifié des circuits très spécifiques qui aident les singes à peser le pour et le contre des décisions, impliquant également les noyaux gris centraux. Graybiel met maintenant au point des outils qui lui permettront d’étudier la façon dont les circuits, qu’elle a identifiés, sont affectés par la mutation MH.
Steve Goldman s’intéresse également aux cellules composant le cerveau mais il s’intéresse à un type de cellules non-neuronales appelées cellules gliales. Ces cellules étaient autrefois considérées comme des cellules de soutien du cerveau, légèrement moins intéressantes et plus ennuyeuses que leurs voisines neuronales. Mais il devient évident que ces cellules possèdent une vaste gamme de rôles essentiels dans le cerveau, ayant surtout une influence sur le fonctionnement du cerveau. Une chose intéressante à propos des cellules gliales : contrairement aux neurones, elles continuent à se diviser dans le cerveau. Le laboratoire de Goldman a montré qu’un nombre relativement faible de cellules gliales injectées se divisent et finissent par peupler l’ensemble du cerveau. Il cherche à comprendre si les changements dans les cellules gliales pourraient contribuer au dysfonctionnement du cerveau. Il a développé une technique très intéressante pour créer des souris ayant des neurones de souris mais des cellules gliales humaines !
En créant des souris ayant des cellules gliales humaines issues de patients MH, Goldman et son équipe peuvent étudier très précisément comment la mutation MH modifie le cerveau MH. Goldman a constaté, lorsque les souris MH ont le gène MH mutant dans leurs cellules gliales mais pas dans leurs neurones, que celles-ci présentaient un dysfonctionnement du cerveau comme dans le cadre de la maladie de Huntington. Ceci est surprenant et soutient l’idée selon laquelle les problèmes afférents aux cellules gliales pourraient ainsi faire partie de la maladie de Huntington humaine. Goldman s’est intéressé au fait de savoir si cela fonctionnait dans l’autre sens – il a introduit des cellules gliales humaines normales dans des cerveaux de souris MH afin de voir si cela pourrait être utile. Les souris MH se portaient mieux et ont vécu plus longtemps lorsqu’elles avaient des cellules gliales humaines, ce qui suggère à nouveau un rôle potentiellement essentiel de ces cellules dans le cadre de la MH.
«Pouvoir mesurer quelque chose ne signifie pas pouvoir bien la mesurer … et pouvoir bien mesurer quelque chose ne signifie pas que c’est important.»
Jeudi après-midi : évaluation et modélisation
Cet après-midi, nous cherchons à évaluer et à modéliser la maladie de Huntington, ce qui est essentiel pour l’exécution des essais cliniques.
Premier à commencer, Doug Langbehn de l’Université de l’Iowa, un expert des statistiques. Il indique : « pouvoir mesurer quelque chose ne signifie pas pouvoir bien la mesurer … et pouvoir bien mesurer quelque chose ne signifie pas que c’est important ». Langbehn a analysé l’ensemble des données issues de l’étude Track-HD exécutée par Sarah Tabrizi de UCL. Cette étude a été la première grande tentative pour comparer tous nos moyens utilisés pour évaluer la maladie de Huntington : moyens cliniques, imagerie, tests psychologiques et autres. Langbehn présente plusieurs réflexions pour aider la conception d’études et donner un sens aux résultats. Nous nous sommes nettement améliorés pour ce genre de choses complexes. Les abandons de participants et la perte de données peuvent gâcher l’analyse des données issues d’études. Des personnes comme Doug travaillent dur pour réaliser ce travail.
Tiago Mestre (Université d’Ottowa) rappelle ensuite les outils d’évaluation clinique de la maladie de Huntington (transformation des symptômes en nombres, utilisés pour tester des médicaments). Certaines échelles d’évaluation vous sont peut-être familières, telles que l’examen neurologique standardisé appelé l’échelle d’évaluation unifiée de la MH (UHDRS). Il est essentiel de comprendre la façon dont les échelles sont fiables : qu’évaluent-elles réellement ? Comment varient-elles au fil du temps et entre différentes évaluations ? Mestre a entrepris un examen systématique d’évaluation et de comparaison de toutes les échelles utilisées dans le cadre de la maladie de Huntington. Il a constaté que des centaines d’échelle d’évaluation différentes avaient été utilisées, rendant difficile la comparaison entre les études. Son équipe a établi des recommandations basées sur des preuves selon lesquelles les échelles doivent être utilisées pour des études et essais futurs.
Jeffrey Long (Université de l’Iowa) a utilisé des données issues de grandes études MH (Track-HD, Predict-HD, COHORT, Registry) afin d’évaluer différentes échelles d’évaluation. L’analyse approfondie de Long fournit de meilleures façons de prédire l’évolution de la MH et de recruter des participants pour des essais cliniques.
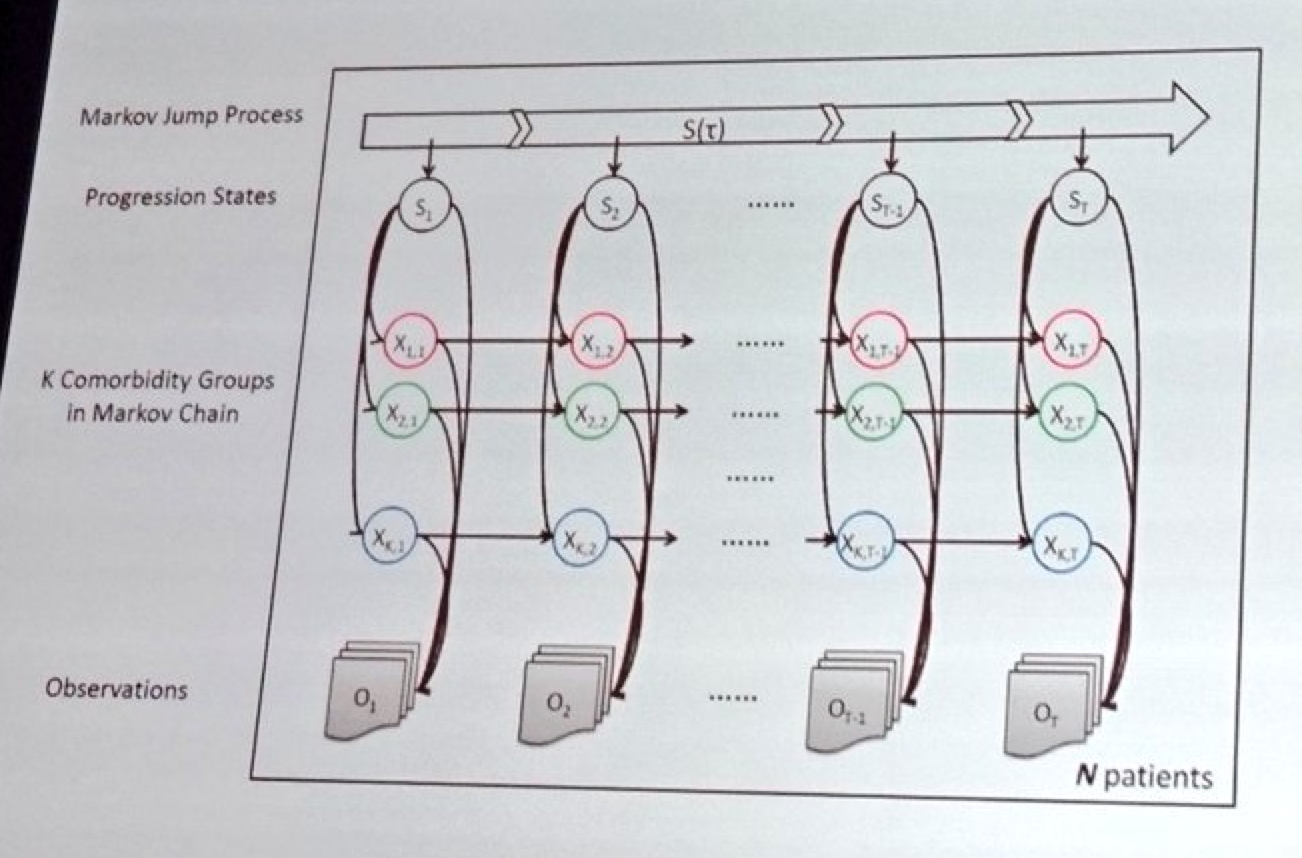
Jianying Hu du laboratoire de Watson (IBM) a offert la puissance de calcul impressionnante de la plate-forme Watson pour l’analyse des données dans le cadre de la MH. Watson a pour objectif de prendre des données provenant d’un grand nombre de sources et à utiliser la ‘machine d’apprentissage’ afin de prédire la progression et comprendre la maladie de Hungtinton. Si nous sommes chanceux, cela sera utile pour nous guider dans des décisions de traitements et d’exécution des essais cliniques. Après avoir mis au point un système de modélisation informatisée des maladies pulmonaires, IBM Watson se tourne maintenant vers la maladie de Huntington.
Et avec cela, la conférence thérapeutique arrive à une conclusion palpitante !
Mais attendez, il y a plus : Une présentation surprise du Dr Rachekl Harding, du Structural Genomics Consortium, portant sur une nouvelle intéressante. Celle-ci est intéressée par l’ouverture du processus scientifique, et elle a eu le courage de mettre ses notes de laboratoire en ligne. Toute personne qui souhaite suivre ses travaux peut prendre connaissance de ce qu’elle fait tous les jours sur son site internet Lab Scribbles ou follow@labscribbles on Twitter. Il s’agit d’une démarche courageuse de « science ouverte ».
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…


