Conférence thérapeutique sur la maladie de Huntington – Jour 3
Compte-rendu de HDBuzz sur la conférence thérapeutique MH annuelle à Palm Springs


Compte-rendu de Rachel Harding et Sarah Hernandez sur la conférence thérapeutique concernant la maladie de Hungtington – le plus grand rassemblement annuel de chercheurs MH.
Veillez à lire le premier jour et le deuxième jour !
Jeudi matin – Diminution de la huntingtine
Bonjour à tous ! Nous sommes de retour pour le troisième jour à la conférence de CHDI à Palm Springs, consacrée à la diminution de la huntingtine. Il y a BEAUCOUP de chercheurs et d’entreprises intéressés par celle-ci !
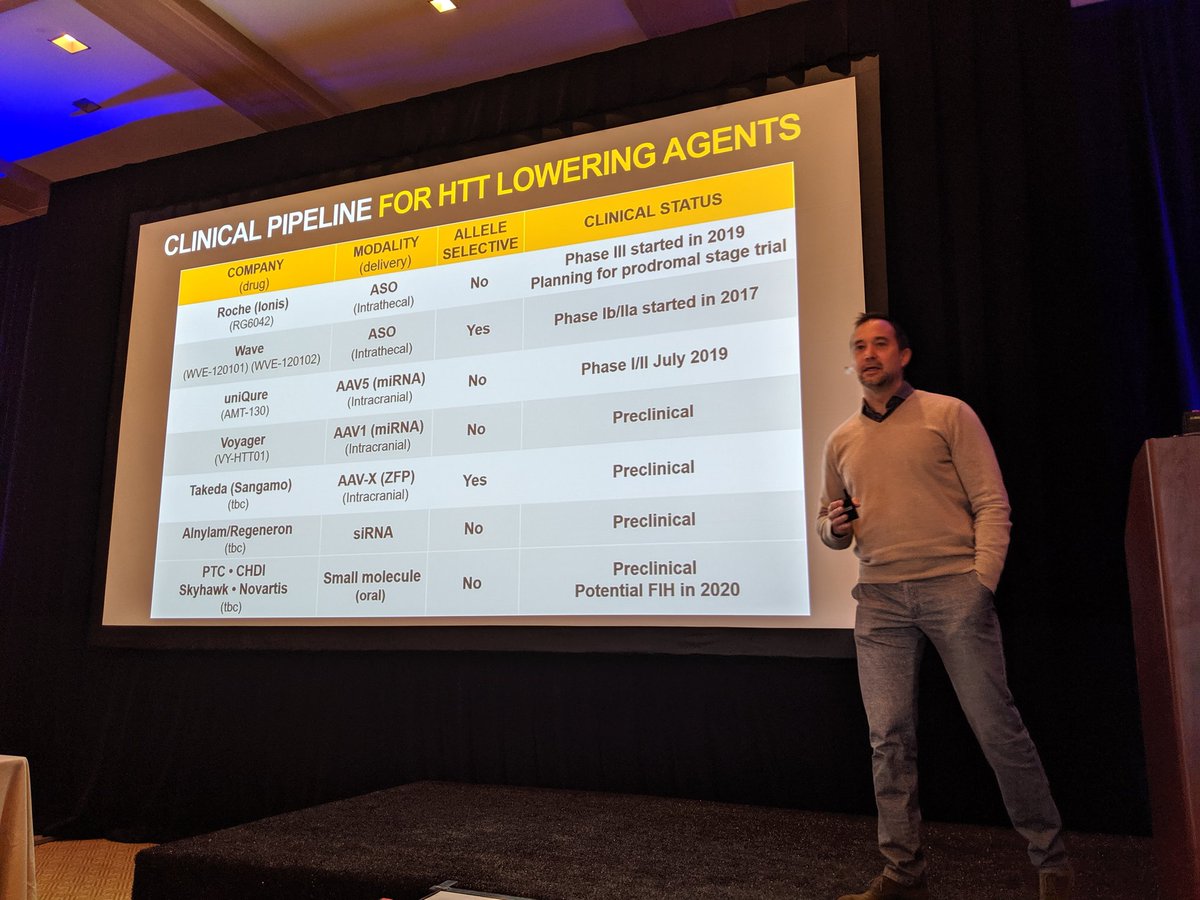
On sait que la diminution de la huntingtine (HTT) chez les souris et les rats aide à atténuer les symptômes MH et la progression de la maladie et qu’il est possible de réduire la huntingtine chez d’autres animaux. Cependant, la question à un million de dollars est de savoir si on peut réduire la huntingtine chez l’homme et si cette réduction aide à traiter les patients. Autres grandes questions : Quand doit-on diminuer la huntingtine ? Doit-on le faire avant que les patients ne présentent des symptômes ou après ? Doit-on réduire la huntingtine dans des zones spécifiques du cerveau ? Ou doit-on le faire dans l’ensemble du cerveau ? Toutes questions auxquelles les essais cliniques actuels tentent de répondre.
On peut être optimiste quant aux essais qui aideront les chercheurs à répondre à ces questions. Les scientifiques ont développé de nombreux moyens pour tenter de réduire la hutingtine, ainsi que toutes sortes d’outils pour évaluer les taux de huntingtine dans le cerveau. De nombreuses thérapies alternatives sont également en préparation.
Premier intervenant : Ignacio Munoz-Sanjuan de la fondation CHDI qui a exposé le timing des stratégies de diminution de la huntingtine. Celui-ci est également très activement impliqué dans la sensibilisation des patients en Amérique latine. Il a créé un organisme à but non lucratif centré sur ses efforts de sensibilisation des patients appelé Factor H.
Les scientifiques veulent s’assurer que toutes les thérapies qu’ils développent soient sans danger pour les patients. La maladie de Huntington affecte tout le corps ; alors que les chercheurs se concentrent sur la diminution de hutingtine dans le cerveau, il est important de comprendre les effets d’un traitement sur l’ensemble du patient. La neurodégénérescence est un problème difficile à cibler ; les scientifiques d’autres domaines, tels que ceux des maladies d’Alzheimer et de Parkinson, sont également préoccupés par la meilleure façon de traiter les patients, et mettre au point de nouveaux médicaments n’est pas une tâche facile, ceux-ci devant donc être prudents pour aller de l’avant.
Les petites molécules constituent un domaine intéressant pour la diminution de la huntingtine. Il s’agit de médicaments qui seraient administrés sous forme de pilule, et par conséquence de nombreuses personnes sont plutôt intéressées à développer davantage cette stratégie. Mais cela ne viserait probablement pas spécifiquement l’expansion de huntingtine mais la huntingtine dans sa totalité. Question essentielle s’agissant de la diminution de la huntingtine : le moment, quand devrait-on traiter pour stopper la maladie ? Peut-on contrer tous les dommages survenus ou peut-on traiter à un stade ultérieur de la maladie ? Le cerveau est un organe vraiment complexe et il est important de rappeler que si les modèles murins sont utiles pour étudier certains aspects de la progression de la maladie, un cerveau d’une souris n’est pas un cerveau d’humain. L’utilisation de nombreux modèles MH différents est la clé essentielle pour étudier l’efficacité des médicaments. Cependant, les souris sont primordiales pour l’avancement de la recherche MH. Depuis que le moment du traitement est un sujet brûlant, les chercheurs ont suivi ce qui arrive lors de l’inversion des effets cellulaires chez les souris. Très intéressant : les chercheurs ont constaté que la diminution de huntingtine chez les souris peut prévenir et contrer les déficits dans les neurones striataux, le type de cellule le plus affecté dans le cerveau des patients MH – Incroyable nouvelle !
Passons maintenant à la promesse de biomarqueurs MH. En bref, il s’agit de mesures que les scientifiques peuvent prendre chez les patients pour suivre la progression de la MH. De bons marqueurs peuvent être utiles pour informer les cliniciens sur la manière et le meilleur moment pour traiter au mieux les patients. La fondation CHDI a passé beaucoup de temps pour développer de nouvelles techniques d’imagerie afin de permettre de visualiser la quantité de huntingtine dans le cerveau et sa localisation. Pour ce faire, ils ont développé une nouvelle molécule qui se lie spécifiquement à la molécule de protéine huntingtine lorsqu’elle se forme dans certaines structures d’amas. Technique qu’on appelle un traceur PET ou PET ligand car les scanners dans lesquels il apparaît sont appelés scanners PET – abréviation de tomographie par émission de positons. La molécule est capable d’entrer dans le cerveau et pourrait donc être utilisée pour suivre la diminution de huntingtine. La fondation CHDI et son équipe mesurent déjà la diminution de ces amas de huntingtine chez différents modèles murins MH. Ils essaient de diminuer la huntingtine dans différentes zones du cerveau de la souris et de traiter également les souris d’âges différents.
Autres questions auxquelles les scientifiques tentent de répondre : Dans quelle mesure il convient de réduire la protéine huntingtine dans les cellules ? Quel taux pourrait être utile pour traiter les patients ? Quels taux sont sans danger ? Ils peuvent utiliser un traceur PET huntingtine ou d’autres expériences pour évaluer les taux de réduction après le traitement et pouvoir ensuite voir à quels taux des modèles murins récupèrent. Ceci pourrait aider à traduire les découvertes faites chez les souris pour les humains.
Prochain intervenant : Mark Bevan de l’Université de Northwestern qui a exposé ses travaux portant sur la diminution de la huntingtine dans une zone spécifique du cerveau.
Ses recherches sont axées sur la manière dont la diminution de la huntingtine pourrait, dans des certaines régions du cerveau, modifier le fonctionnement de celui-ci et comment cela pourrait affecter les symptômes chez les patients. Comme beaucoup d’autres chercheurs, Bevan s’intéresse aux différences de types spécifiques de cellules engendrées par la MH. Son groupe constate, chez des modèles murins MH, qu’un certain type de neurones est moins actif alors que d’autres semblent ne pas être affectés. En observant des modèles murins MH, Bevan a découvert qu’il existe des différences dans la façon dont les neurones communiquent entre eux et il utilise ses expériences d’observation sur la communication de neurone à neurone pour étudier les effets de la diminution de huntingtine chez ces souris. En diminuant la hutingtine chez les souris MH, celui-ci constate que les déficits moteurs sont améliorés ; les souris sont capables de parcourir de plus longues distances à une vitesse plus rapide. Excellente nouvelle depuis les essais cliniques humains actuels qui n’ont pas encore divulgué de données concernant les changements qui pourraient être constatés sur les symptômes. Bevan et ses collègues continuent d’observer la diminution de la huntingtine sur d’autres déficits moteurs et ainsi de suite chez leurs modèles murins. Ils espèrent que leurs résultats pourraient éclairer la façon dont les thérapies de diminution de la huntingtine pourraient se traduire en clinique.
Prochain intervenant : Marcy MacDonald du Massachusetts Général Hospital dont l’exposé s’intitule « les limites extérieures » ! Les chercheurs découvrent, à partir de l’étude Enroll-HD, qu’il existe de nombreuses variabilités qui proviennent de facteurs autres que la longueur de la répétition CAG. Bien que cela ait été une grande découverte dans le domaine de la MH, cela indique vraiment à quel point cette maladie est complexe, même si les chercheurs connaissent la cause génétique. Bien que nous ayons tous un gène huntingtin et que des patients MH possèdent des répétitions CAG plus longues que d’autres, nous avons également d’autres petites variations dans la séquence du gène huntingtin auxquelles des chercheurs, comme MacDonald, s’intéressent pour les étudier et les cibler thérapeutiquement.
L’équipe de MacDonald a généré de très nombreuses données sur ce qui peut modifier la progression de la maladie de Huntington. Ils partagent toutes leurs données afin que tous les scientifiques du monde entier puissent y travailler ensemble – plusieurs paires d’yeux valent toujours mieux qu’une. Heureusement, MacDonald a identifié des personnes qui ont une expression réduite de la huntingtine. Ces personnes se portent bien, de sorte que les chercheurs savent que la diminution de la huntingtine à des taux moindres ne devrait pas avoir d’effets néfastes. Dans la mesure où les taux d’expression de la huntingtine varient au sein de la population et que des personnes semblent bien se porter, il s’agit d’une bonne nouvelle pour les stratégies de diminution de la huntingtine. Ceci suggère que la modification des taux de huntingtine pourrait ne pas avoir d’effets secondaires néfastes. Une chose à noter cependant : chez des modèles murins, lorsque la huntingtine est réduite (spécifiquement dans le foie), les cellules sont moins capables de supporter le stress. Encore une fois, il est très important pour les chercheurs de tester minutieusement la sécurité de toutes les stratégies de diminution de la huntingtine.
Dans la mesure où les taux d’expression de la huntingtine varient au sein de la population, les chercheurs doivent également être conscients que les taux de huntingtine initiaux chez les patients peuvent être différents dans des essais de diminution de la huntingtine. On pourrait donc imaginer à l’avenir une approche plus personnalisée pour chaque patient. Il s’agit de tous les points que les compagnies, menant des essais portant sur la diminution de huntingtine, prennent en considération dans leur conception d’essais. Nous avons tous hâte d’entendre davantage de mises à jour de ces essais dans la session de l’après-midi.
Jeudi après-midi – Prendre en considération la diminution de la huntingtine au niveau clinique

Bon après-midi ! Cette session est axée sur la traduction de la diminution de la huntingtine en clinique.
Premier intervenant : Charlotte Sumner de Johns Hopkins qui a exposé certains des défis associés au ciblage thérapeutique des gènes. Celle-ci se concentre principalement sur une autre maladie neurodégénérative appelée amyotrophie spinale (SMA), pour laquelle il existe actuellement un traitement ASO, et en conséquence, le domaine MH peut en apprendre beaucoup en observant ce qu’ils font. Comme pour la maladie de Huntington, les chercheurs connaissent la cause génétique précise de l’amyotrophie spinale. Cependant, leurs connaissances sur ce qui se passe avec les molécules de protéines dans la cellule est beaucoup plus floue, de sorte que les moteurs de la maladie ne sont pas complètement clairs. Dans la mesure où la génétique est claire, il existe un certain nombre de thérapies géniques différentes qui ont été développées pour l’amyotrophie spinale. Outre une thérapie ASO approuvée, il existe également de petites molécules (prises sous forme de pilules) qui diminuent le gène cible actuellement à l’étude à la FDA. Il a également été démontré qu’une thérapie de remplacement génique à dose unique ou « one-shot », qui fixe directement la séquence d’ADN, fonctionne bien chez les jeunes enfants atteints d’amyotrophie spinale et des travaux sont en cours pour voir si ce traitement agirait bien pour des patients plus âgés. Dans le cadre d’essais SMA, certains patients se sont considérablement améliorés s’agissant de divers paramètres qui ont été évalués. Ces découvertes sont très encourageantes pour le domaine de la recherche MH où les chercheurs espèrent appliquer certaines de ces stratégies réussies dans le domaine de la SMA. Plus tôt dans la conférence, il a été question des chercheurs qui souhaitaient déterminer le meilleur moment pour traiter la MH. Dans le domaine de la SMA, ils ont constaté que le timing était vraiment important ; donc c’est très bien de voir que la recherche MH est sur la bonne voie.
Dans la mesure où les patients SMA ont réagi différemment aux traitements, les chercheurs SMA souhaitent obtenir davantage de données sur les patients pour comprendre les raisons potentielles de cette variation. Cela renforce la raison pour laquelle des études, telles que Enroll-HD, seront utiles à la recherche MH. Les chercheurs SMA tentent maintenant de trouver le meilleur moyen de traiter et de surveiller leurs patients, c’est-à-dire la quantité de médicament à administrer. Quand et à quelle fréquence doit-il être administré ? Les chercheurs espèrent que cela devrait améliorer les résultats des patients. Une nouvelle fois, comme pour la MH, les chercheurs SMA s’intéressent aux neurofilaments à chaîne légère en tant que biomarqueur pour la progression de la maladie. Ils surveillent les taux des neurofilaments à chaîne légère chez les patients qui sont traités avec différentes thérapies SMA et les taux de ceux-ci semblent diminuer dans le temps avec le traitement.
Prochain intervenant : Anastasia Khvorova qui travaille à l’Université du Massachusetts Médical School et a parlé d’une technique utilisée pour la diminution de la huntingtine appelée ARNi. Semblables aux ASOs, les thérapies basées sur l’ARNi ciblent le message huntingtin plutôt que l’ADN ou la protéine, agissant pour détruire l’étape intermédiaire afin que la protéine ne soit jamais produite. Pour en savoir plus sur l’ARNi et en quoi il diffère des ASO ici.
Pour tester la façon dont l’ARNi ciblant la huntingtine affecte la maladie, Khvorova et son équipe ont d’abord analysé les effets chez des souris. La première étape a été d’évaluer comment leur traitement se propage dans le cerveau – résultats très prometteurs ! Après le traitement, ils ont constaté que la huntingtine avait diminué de manière significative dans de nombreuses zones du cerveau. Ces travaux ciblaient à la fois l’expansion HTT et la huntingtine dans sa totalité, mais ils travaillent également sur des approches qui cibleront uniquement l’expansion HTT. En effectuant des modifications adéquates aux molécules ARNi, Khvorova et son équipe ont pu rendre leur traitement sélectif uniquement pour le message de l’expansion HTT afin que seule cette protéine soit diminuée et non la huntingtine dans sa totalité. Toutefois, il convient de noter que cela ne fonctionnera que chez environ 35% des patients qui présentent une légère différence dans leur séquence de gène huntingtin appelée polymorphisme associé à un seul nucléotide (SNP prononcé « snip »). Cela permet au traitement ARNi de sélectionner l’expansion HTT par rapport à l’HTT dans sa totalité. Ensuite, ils voulaient voir comment leur traitement ARNi agissait chez des plus grands modèles animaux, ils sont alors passés de la souris au mouton. En utilisant des moutons, ils ont testé les diverses méthodes d’administration pour trouver le traitement qu’ils pourraient injecter dans le cerveau ou dans le liquide céphalo-rachidien, et cela fonctionne de la même manière.
Après les moutons, Khvorova et ses collègues sont passés aux singes et ont constaté à nouveau que le traitement ARNi se propageait assez bien dans le cerveau et à travers la moelle épinière. Il demeure dans ces zones assez longtemps et les chercheurs ne prévoient donc pas de devoir traiter très fréquemment. Lors d’une première étude d’innocuité chez ces singes, la thérapie semble sans danger à la dose testée. De même, les premières données d’une étude d’innocuité sur le mouton ont révélé que la thérapie était sans danger dans les conditions testées par les scientifiques. Bonne nouvelle : la huntingtine a diminué de manière significative dans ces premières études sur les singes. Les taux d’autres gènes semblent être inchangés, ce qui signifie que les effets hors cible ou secondaires semblent faibles dans la façon dont les scientifiques ont évalué leur expérience. Toutefois, la recherche de changements, même minimes, dans d’autres gènes est vraiment importante ; le travail actuel de Khvorova et ses collègues est de s’assurer qu’il n’y a pas de différences et de confirmer l’innocuité de cette thérapie. Khvorova et ses collègues, ainsi que la fondation CHDI, considèrent cette technologie comme très prometteuse. Celle-ci pourrait être utilisée pour modifier les taux d’autres protéines dans le cerveau, telles que celles identifiées comme modificateurs de l’âge d’apparition des symptômes chez les patients MH ou d’autres cibles. L’une des choses auxquelles ils prêtent attention est le coût. Ils essaient de réduire le coût afin que ce traitement soit largement disponible pour tous les patients atteints de MH. Nous attendons avec impatience d’autres mises à jour sur cette recherche prometteuse alors qu’ils se dirigent vers la clinique !
Prochain intervenant : Astrid Valles-Sanchez de la compagnie uniQure qui a parlé de l’approche de cette compagnie pour diminuer la huntingtine. Celle-ci a un traitement appelé AMT-130 et réalise actuellement un essai clinique pour déterminer l’innocuité de celui-ci. AMT-130 a été conçu pour une injection unique du traitement de diminution de la huntingtine dans le cerveau. Valles-Sanchez a concentré son exposé sur les biomarqueurs qu’ils évaluent pour déterminer si l’efficacité de ce traitement modifiera la progression de la maladie. Lorsqu’ils ont examiné un modèle porcin, ils ont constaté que leur traitement était détecté dans le liquide céphalo-rachidien sur deux ans. Chez les singes, ils ont détecté leur traitement jusqu’à six mois lorsque les animaux ont été sacrifiés. Similairement à d’autres études, la compagnie uniQure veut vérifier que leur thérapie se propage à travers le cerveau pour voir où celle-ci pourrait agir. Chez un modèle porcin, 12 mois après le traitement, ils ont analysé le tissu de différentes régions du cerveau pour voir avec quelle efficacité leur traitement a réduit la huntingtine. Ils ont constaté une diminution significative de l’expansion huntingtine avec une diminution plus marquée dans les zones cérébrales les plus affectées par la MH. La compagnie uniQure a également examiné les taux de l’expansion huntingtine dans le liquide céphalo-rachidien après le traitement des modèles porcins MH avec l’AMT-130 mais dans cette expérience particulière, les taux dans le liquide céphalo-rachidien ne sont pas en corrélation avec les niveaux de huntingtine trouvés dans le cerveau. Les scientifiques de la société uniQure s’intéressent à l’utilisation de la spectroscopie par résonance magnétique, un moyen non-invasif pour examiner le cerveau afin de voir s’il existe des changements dans des substances chimiques appelées métabolites qui se situent dans différentes régions cérébrales après le traitement.
Le dernier intervenant est Scott Schobel qui a exposé quelques nouveaux résultats très préliminaires de l’essai mené par le groupe Roche. Ces résultats sont issus de 15 mois d’étude en extension ouverte de patients MH symptomatiques ; il convient d’être un peu prudent quant à l’interprétation de ces données précoces mais il est tout de même intéressant de voir ce qu’ils ont trouvé.
Et c’est pour cette année la conférence HD Theraputics ! Veillez à avoir lu le Jour 1 ici et le Jour 2 ici et suivez la conversation sur Twitter. Comme dans de nombreux projets du domaine de la recherche MH, il existe un grand effort de collaboration entre de nombreux chercheurs qui travaillent ensemble pour trouver des solutions. Le médicament RG6042 a un nouveau nom ! La thérapie s’appellera désormais tominersen. Les patients de l’étude d’innocuité initiale ont été maintenus dans une étude d’extension en ouvert, ce qui signifie qu’après la fin de l’essai d’innocuité, ils continuent à bénéficier de la thérapie et les données qui sont exposées à ce jour sont celles que les scientifiques ont constaté depuis la fin de cet essai. Récapitulatif : cette thérapie ne sélectionne PAS l’expansion du gène huntingtin, elle est conçue pour diminuer à la fois les taux de l’expansion de la protéine huntingtine et ceux de la huntingtine dans sa totalité. Les personnes du groupe Roche et leurs collaborateurs travaillent maintenant depuis plusieurs années avec différents modèles animaux afin de déterminer les doses nécessaires pour diminuer les taux de la protéine huntingtine et la façon d’évaluer la diminution de huntingtine en examinant le liquide céphalo-rachidien. Il y a deux ans, lors d’une conférence CHDI, Sarah Tabrizi de UCL a communiqué les premiers résultats de l’étude d’innocuité. En seulement deux petites années, les chercheurs ont fait d’énormes progrès s’agissant de la diminution de huntingtine avec de nombreuses stratégies maintenant disponibles – très intéressant !
Aux termes de l’étude d’innocuité, il semblerait que les niveaux de protéine huntingtine pouvaient être réduits d’une manière proportionnelle à la dose de médicament tominersen, ce qui signifie que la protéine a été davantage réduite chez des patients ayant reçu davantage de traitement dans le petit nombre de patients testés. L’étude d’extension en ouvert teste deux stratégies de doses, les participants ont été dosés soit tous les mois, soit tous les deux mois. Ce type de conception est essentiel pour la fréquence à laquelle le médicament tominersen devrait être administré chez les patients. Les chercheurs ont constaté qu’une bonne diminution de la huntingtine avait été observée même lorsque le médicament tominersen a été administré tous les deux mois. Les deux groupes de patients n’avaient que très peu de personnes n’ayant pas terminé cette étude d’extension en ouvert. Compte tenu des paramètres examinés par le groupe Roche, les données indiquent que le médicament tominersen doit être administré tous les deux mois plutôt que chaque mois. Dans la mesure où ils ont constaté qu’un dosage moins fréquent était efficace pour réduire la huntingtine, ils ont modifié la stratégie pour le prochain bras de l’étude (Phase III) afin de réduire le nombre de doses et de tester le dosage toutes les 16 semaines – beaucoup moins exigeant pour les patients !
Le suivi des taux des neurofilaments, un biomarqueur MH proposé pour surveiller la progression de la maladie, pourrait être utile afin de voir l’efficacité des traitements et le groupe Roche continue d’étudier les taux des neurofilaments dans l’essai clinique. Ils ont constaté que les taux des neurofilaments à chaîne légère ont une augmentation initiale mais leurs quantités semblent diminuer et même s’équilibrer à 15 mois. Le groupe Roche souhaite approfondir la compréhension du biomarqueur NfL et étudie la biologie sous-jacente qui pourrait lier la hutingtine et les neurofilaments à chaîne légère. Il existe davantage de travaux cliniques en cours chez le groupe Roche qui, espérons-le, continueront d’informer les chercheurs MH quant à l’efficacité de cette thérapie. Schobel a aimablement partagé ses diapositives en ligne !
Et c’est tout ! Nous espérons que ces tweets en direct vous ont tous été utiles, nous nous réjouissons déjà pour l’année prochaine!
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…