
Conférence thérapeutique 2022 sur la maladie de Huntington – Jour 1
Découvrez les mises à jour de la recherche du premier jour de la conférence thérapeutique MH 2022 #HDTC2022
Bonjour de Palm Springs ensoleillé ! Après une interruption de deux ans du fait de la COVID, la conférence thérapeutique MH est de retour en personne cette année – le plus grand rassemblement annuel de chercheurs MH ! Nos mises à jour Twitter sont compilées ci-dessous. Continuez à suivre les mises à jour en direct pour le reste de la conférence avec le hashtag #HDTC2022.
Le premier jour est axé sur les mises à jour de la recherche de certains des meilleurs laboratoires MH du monde.
Eléments constitutifs de la protéine huntingtine
Les Docteurs Paolo Beuzer (CHDI) et Vanessa Wheeler (MGH) présentent la première session de la conférence qui sera axée sur les moyens d’étudier et potentiellement de manipuler les répétitions CAG dans l’ADN et l’ARN huntingtin.
Les répétitions CAG – plus complexes qu’elles n’y paraissent
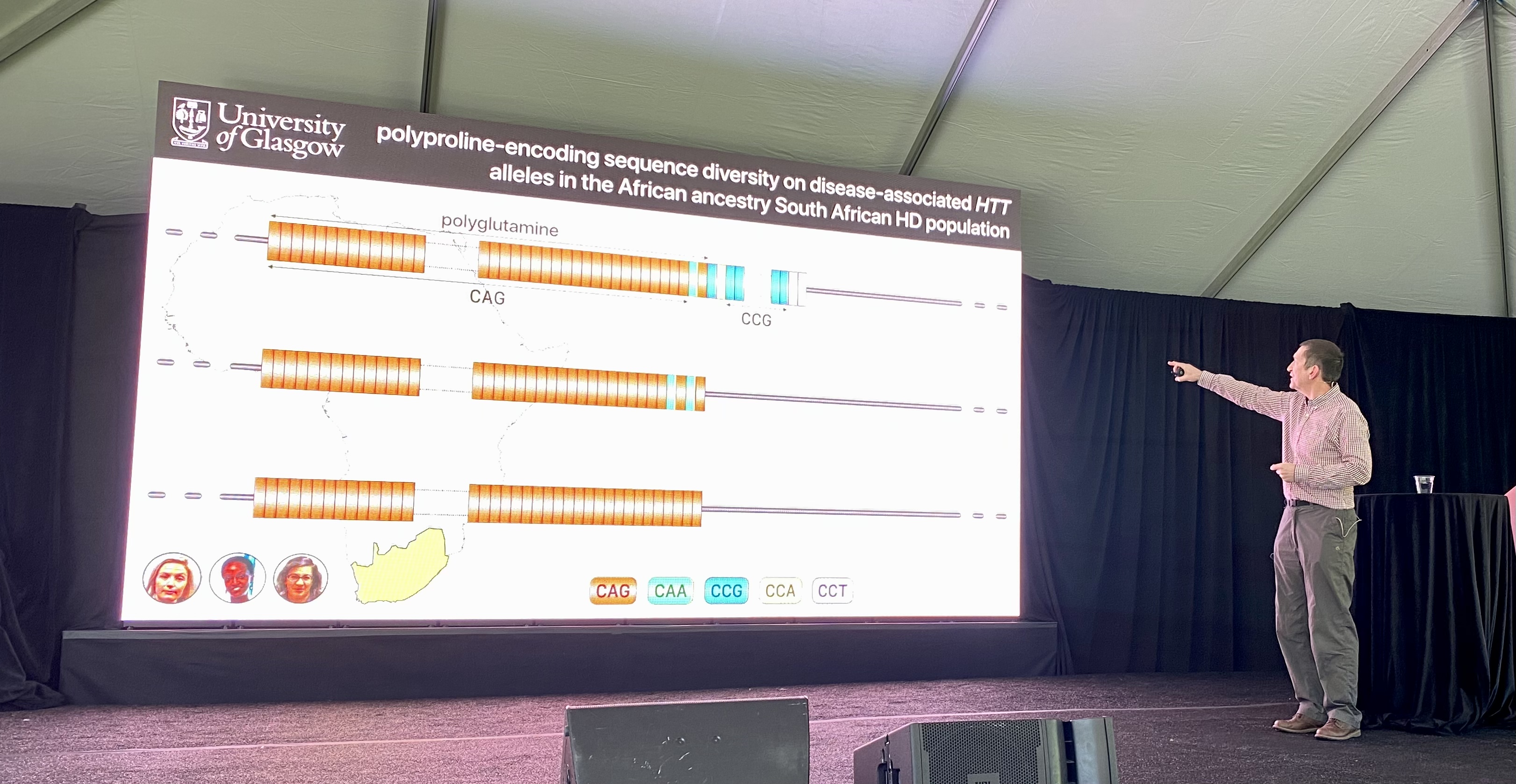
Le premier conférencier de la journée est Darren Monckton de l’université de Glasgow. Le laboratoire de Monckton étudie les répétitions dans la séquence ADN dans le cadre de maladies comme la maladie de Hutington.
Bien que la répétition CAG semble simple car elle est si courte, elle est en fait assez compliquée. La taille de la répétition CAG à elle seule ne tient pas compte de l’âge auquel une personne développera des symptômes MH. CAG code pour la glutamine, un bloc de construction protéique. Mais d’autres lettres protéiques peuvent également coder pour la glutamine. Ainsi, CAA peut également contribuer aux polyglutamines dans le cadre de la MH. Ces interruptions CAA peuvent également affecter l’âge auquel une personne présente des symptômes. Avoir une interruption CAA, ce qui est rare, provoque un âge d’apparition plus précoce par rapport aux personnes MH qui n’ont que des répétitions CAG pures. Des changements dans la « pureté » des répétitions CAG, c’est-à-dire qu’il y ait ou non ces interruptions, pourrait affecter un processus appelé l’instabilité somatique, au sujet duquel nous avons publié : https://en.hdbuzz.net/291
La base de données de l’étude EnrollHD, desquelles ces observations ont été faites, est biaisée par des données provenant de nombreux individus européens et nord-américains mais non par d’autres parties du monde. Le laboratoire Monckton a décidé de s’attaquer à cela en collaborant avec un groupe en Afrique du Sud. Il a observé, dans cette population sud-africaine, une distribution très semblable des différents types de codes CAG, avec ou sans ces interruptions. Cependant, il y avait quelques différences dans une autre partie du gène huntingtin.
Après les CAGs, la protéine huntingtine contient les lettres CCG composant un bloc de construction protéique appelé proline. Le laboratoire Monckton a séquencé le nombre de prolines chez des patients MH en Afrique du Sud et a constaté que cette partie de la protéine diffère de celle des patients MH d’origine européenne. Ils ont utilisé ces données pour examiner comment le nombre de répétitions de proline et les lettres qui composent ces répétitions de proline affectent l’âge d’apparition de la maladie. Les personnes MH dont les prolines avaient une orthographe légèrement différente présentaient des symptômes MH 10 ans plus tôt.Suivre la façon dont ces blocs de construction protéiques sont orthographiés peut aider à améliorer le diagnostic ou la prédiction de l’âge d’apparition de la maladie. Dans l’ensemble, cela signifie que d’autres changements dans la recette génétique de la huntingtine peuvent affecter la maladie – la génétique MH s’avère beaucoup plus embêtante et complexe qu’il n’y paraît à première vue. Comprendre ces variations qui conduisent à une apparition précoce ou tardive des symptômes pourrait aider les chercheurs à trouver de nouveaux moyens pour mettre au point des médicaments pour les personnes atteintes de la MH – c’est l’espoir.
Les chercheurs concluent que ces autres changements dans la recette de la huntingtine n’affectent pas l’instabilité somatique mais affectent peut-être le message émis à partir de la recette de la huntingtine. La structure de la molécule messager ARNm pourrait changer. Fait intéressant, aucun des changements, que nous venons de décrire, ne modifie la protéine huntingtine elle-même. Ils modifient seulement l’orthographe du gène ou de la « recette », ce qui suggère que ce ne sont pas les changements associés aux protéines qui affectent la maladie mais plutôt des changements au niveau de l’ARN. La modification de l’orthographe de l’ARN peut changer la façon dont la molécule se replie. Personne ne sait encore ce que signifient ces changements de repliement mais ils pourraient être exploités pour développer des thérapies.
Docteur Monckton conclut, même si tout cela semble si simple, que les personnes MH ont des répétitions CAG accrues – c’est en fait très compliqué ! Mais des recherches comme celle-ci étudient comment nous pourrions tirer parti de cette complexité pour concevoir de nouveaux médicaments.
Examiner comment la maladie de Huntington affecte les cellules cérébrales individuelles
Le prochain intervenant est Steve McCarroll, affilié au Havard Medical School et Broad Institute, qui nous parlera de ses recherches sur la compréhension de la MH au niveau des cellules cérébrales individuelles.
Le cerveau est constitué de plusieurs types de cellules différents qui remplissent des fonctions spécifiques. Le Dr McCarroll souligne la nécessité de comprendre comment ces nombreux types de cellules différents sont affectés par la MH. Son laboratoire utilise des techniques spéciales pour séparer les différents types de cellules et comprendre leur génétique. Ils se sont engagés à partager largement la méthodologie au profit de l’ensemble de la communauté de recherche MH.
Le Dr McCarroll a trouvé un moyen pour accélérer son analyse – il combine ensemble des échantillons de cerveaux humains provenant de patients MH, puis sépare les données après. Obtenir les données plus rapidement est un gros avantage car cela permet aux chercheurs d’obtenir leurs réponses le plus rapidement possible. Ces types d’analyses à grande échelle sont rendus possibles grâce aux dons de cerveau suite au décès d’une personne atteinte de la MH. Les dons de cerveau pour la recherche MH sont un moyen majeur pour obtenir des réponses s’agissant du seul organisme dont nous nous soucions de guérir de la MH – celui de l’humain.
Le laboratoire de McCarroll applique ces techniques pour comprendre comment la proportion des différents types de cellules cérébrales change à mesure que les symptômes MH progressent. Il a déterminé ces changements au fur et à mesure que la maladie progresse, ce qui nous aide à comprendre la composition cellulaire du cerveau des personnes MH. Chez la plupart des personnes MH, il y a une perte importante de cellules appelées les neurones épineux moyens. Les chercheurs le savent depuis un certain temps, mais le Dr McCarroll a également constaté qu’il existe des changements cellulaires dans de nombreux autres types de cellules cérébrales. La perte de cellules est accompagnée par des changements dans l’activation et la désactivation de gènes. Le Dr McCarroll a cartographié ces changements dans ces gènes, dans chaque type de cellule au fur et à mesure que la maladie progresse, waouh !
Ces types de données peuvent identifier différents gènes dans des cellules spécifiques qui modifient la maladie. L’une de ces modifications liées à la maladie est associée à l’expansion de la répétition CAG au fur et à mesure que la personne MH vieillit.
Certaines personnes atteintes de la MH ont une augmentation de répétitions CAG au fil du temps, en particulier dans le cerveau. Ces expansions peuvent augmenter l’âge d’apparition pour les patients MH. Comprendre les causes de ces expansions pourrait aider à développer des médicaments afin de retarder le début de la maladie. D’autres gènes, appelés modificateurs génétiques, interviennent dans le temps s’agissant du développement et du nombre de répétitions CAG d’une personne. Le laboratoire de Mc Carroll étudie ces modificateurs génétiques dans les cellules individuelles de nombreuses personnes !
Savoir comment ces processus changent à un si petit niveau produit BEAUCOUP de données, lesquelles donneront des tonnes d’informations sur la façon dont l’expansion CAG change dans divers types de cellules et comment cela affecte l’évolution de la maladie. Fait intéressant, il a constaté que ces expansions CAG se produisaient beaucoup dans les neurones épineux moyens, lesquels sont l’un des types de cellules le plus affecté par la MH. Cela pourrait être l’une des raisons pour lesquelles ce type de cellule particulier soit si vulnérable dans le cadre de la MH. Il a également déterminé ces changements dans différents types de cellules cérébrales, ainsi que dans différentes parties du cerveau. Selon l’endroit du cerveau où se trouve un certain type de cellule, cela peut également affecter l’expansion CAG dans ce type de cellule. Ce n’est donc pas seulement l’identité de la cellule qui compte, mais également l’emplacement de celle-ci. Comprendre pourquoi le type de cellule et le « voisinage » dans le cerveau affectent l’expansion CAG sera une prochaine étape importante vers le développement de thérapies pour la combattre. Ces données du laboratoire McCarroll sont fraîchement sorties des presses et reflètent les récentes percées dans les techniques de laboratoire et d’analyse. Ils prévoient d’appliquer ces techniques à davantage d’échantillons de personnes présentant différents stades de MH.
Les modèles murins MH
L’intervenant suivant est le Dr William Yan de l’Université de Californie (Los Angeles) qui nous parlera de son nouveau modèle murin que son laboratoire a récemment développé. Nous avons récemment écrit au sujet de ce nouveau modèle : https://en.hdbuzz.net/318
Aucun modèle murin MH n’est parfait pour étudier la maladie de Huntington mais différents types peuvent capturer différents aspects de la maladie et permettre différents types d’expériences. Depuis plusieurs années le laboratoire Yang s’est spécialisé dans la création de modèles murins afin de répondre à des questions spécifiques s’agissant de la MH. Le choix du bon modèle pour des expériences spécifiques est essentiel dans la mesure où certains modèles murins ne présentent que certaines caractéristiques de la MH, telles qu’une expression altérée du gène ou l’agrégation de protéines. La principale innovation du nouveau modèle murin du laboratoire de Yang est qu’il présente une instabilité somatique, la croissance des répétitions CAG dans certaines cellules au fil du temps. Celui-ci permet aux chercheurs de comprendre les conséquences de l’expansion sur la santé et le comportement d’une souris. Chez ces souris, plus les répétitions CAG augmentent, plus leur comportement et la santé de leurs cellules cérébrales sont affectés, confirmant pour la première fois chez les animaux ce que nous avons suspecté sur la base de données provenant de dons de sang humain, de liquide céphalo-rachidien et de cerveau. Le laboratoire utilise maintenant leur nouveau modèle murin pour mieux comprendre comment les répétitions CAG instables, en expansion affectent la recette et la protéine huntingtine et les dommages qu’elles peuvent causer dans les cellules.
Le Dr Yang a également partagé des données provenant d’un autre type de modèle murin MH qui leur permet d’étudier comment les gènes sont activés et désactivés au cours de la MH. C’est formidable de voir cette question abordée sous plusieurs angles (avec le laboratoire McCarroll et d’autres). Nous prenons une petite pause maintenant, mais nous reviendrons sous peu avec des mises à jour d’autres intervenants de cette matinée. Restez à l’écoute!
Traitement du message huntingtin
Notre prochain intervenant est le Dr. Gillian Bates de Queen Square Institute of Neurology, Université Collège Londres qui nous informera sur la manière dont le gène huntingtin est traité et sur la manière dont nous pouvons peut-être utiliser ces informations pour développer des thérapies.
Le gène huntingtin est « épissé » pour éliminer des petits morceaux d’informations génétiques qui se trouvent entre le code. Le gène est ensuite reconstitué avant que la protéine ne soit produite. Ce processus est généralement utilisé pour donner aux cellules une diversité dans les informations qu’elles peuvent créer à partir d’un seul gène. Mais ce processus peut devenir mauvais dans le cadre de la MH. Dans le cadre de cette maladie, le gène huntingtin est utilisé pour créer un très petit fragment d’une protéine appelée « exon 1 ». Cette protéine exon 1 contient les répétitions CAG et est très toxique pour les cellules.
Le Dr. Bates étudie les quantités de exon 1 chez des modèles murins MH et dans différentes parties des cerveaux provenant de personnes atteintes de la MH. Elle a constaté qu’avec des répétitions CAG plus longues, le processus d’épissage créant la protéine exon 1 se produisait plus fréquemment. Le laboratoire Bates expérimente des moyens pour détecter et distinguer entre les différentes formes et morceaux de la protéine huntingtine créée par épissage. Pour ce faire, il utilise différentes combinaisons d’anticorps, un moyen de détecter différentes partie de la protéine. Ce travail suggère que le fragment de l’exon 1 est le lieu de création de l’agrégation des protéines. Comprendre comment ce processus se produit peut nous donner de nombreux indices sur la manière de réduire les amas de cette protéine.
Le laboratoire Bates se spécialise dans des moyens innovants pour tenter de voir différentes formes de la protéine au microscope ou dans un essai, comme la création de nouvelles souris et le traitement du tissu avec différents produits chimiques. Il a créé un modèle murin spécial où le schéma de l’épissage est modifié et où le fragment de l’exon 1 de la protéine huntingtine ne devrait plus être produit. Le laboratoire étudie chez ces souris les taux des amas de protéines toxiques par rapport à ceux des modèles murins MH ordinaires. Chez le nouveau modèle murin, il y avait beaucoup moins d’amas, ce qui suggère que le fragment de l’exon 1 est important dans la formation d’amas. Les prochaines étapes consisteront à explorer comment les différences dans les amas de la huntingtine pourraient modifier le comportement de la souris et le schéma de communication entre les cellules cérébrales. Parfois les amas de la huntingtine apparaissent près du noyau de la cellule – la partie de celle-ci qui abrite le matériel génétique. Le laboratoire Bates a utilisé plusieurs modèles afin de montrer que cela ne se produit qu’avec la huntingtine humaine, pas avec la huntingtine de la souris. Ces données suggèrent qu’il y a quelque chose d’unique s’agissant de la huntigtine humaine qui conduit à ces amas de protéine pathogènes. Cela pourrait être un indice de la raison pour laquelle les humains sont la seule espèce à avoir naturellement la MH !
Comprendre quelles formes de la huntingtine sont les plus toxiques et pourquoi nous aidera à concevoir des médicaments afin de lutter contre ses effets négatifs sur les cellules cérébrales (humaines !).
Manipulation cellulaire de la protéine huntingtine
Prochain intervenant : Dr. Judith Frydman de l’Université de Stanford qui expliquera pourquoi les expansions répétées de CAG peuvent conduire à des problèmes avec les systèmes de « marquage et d’élimination des déchets » dans les cellules cérébrales.
Bien que nous connaissions la cause de la maladie de Huntington, les chercheurs ne connaissent pas vraiment la fonction « normale » de la protéine huntingtine. Ce qu’ils savent, c’est qu’elle participe dans une variété de processus biologiques différents – un peu comme s’il s’agissait du couteau suisse de la cellule. Pour cette raison, les chercheurs se demandent si la MH est une maladie causée par une perturbation d’autres gènes ou par une perturbation d’autres protéines. Le travail du Dr. Frydman soutient que la MH, au moins en partie, résulte d’une perturbation au niveau de la protéine.
La recherche du Dr Frydman vise à comprendre comment la molécule messager huntingtin, appelé ARNm, est transformé en molécule protéique, par un processus appelé traduction. Les stress sur les cellules (des choses telles qu’une infection virale, une disponibilité réduite des blocs de construction protéiques et des changements dans le fonctionnement de la machinerie cellulaire) peuvent modifier la façon dont la traduction se produit. Les chercheurs savent que les cellules des personnes ou des modèles animaux atteints de la MH présentent des niveaux accrus de stress cellulaire. Le laboratoire du Dr. Frydman a montré chez ses modèles que, dans ces conditions de stress, davantage de protéine huntingtine était produite. Lorsque les cellules fabriquent la protéine huntingtine par traduction, elles utilisent une machinerie appelée les ribosomes. Le Dr. Frydman et ses collègues montrent que lorsque les cellules fabriquent la huntingtine mutée, les ribosomes se heurtent et cause un embouteillage sur le message huntingtin. Lorsque le laboratoire Frydman a examiné quels gènes avaient été modifiés sur le message, avec et sans embouteillage, il a constaté que bon nombre de ces gènes étaient impliqués dans le nettoyage des protéines au sein des cellules.
Une protéine, appelée elF5A, est réduite chez les modèles MH. Celle-ci est importante pour aider les ribosomes à éliminer l’embouteillage, de sorte que s’il y a moins de cette protéine dans le cadre de la MH, il y aura davantage de problèmes pour fabriquer de nouvelles molécules protéiques et éliminer les anciennes. Les travaux du Dr. Frydman suggèrent qu’une multitude de perturbations moléculaire, résultant de la MH, se produisent au niveau du message ARN et de la protéine huntingtine, chacune contribuant aux signes et symptômes de la MH que nous observons chez les patients et les modèles MH.
Effets pathologiques de la huntingtine
La deuxième session est animée par le Dr. Balajee Somalinga (Fondation CHDI) et le Dr. Ali Brivanlou (Université Rockefeller) et sera principalement axée sur le message et la protéine huntingtine, ainsi que leurs rôles dans la santé et la maladie.
Les premiers effets de la huntingtine
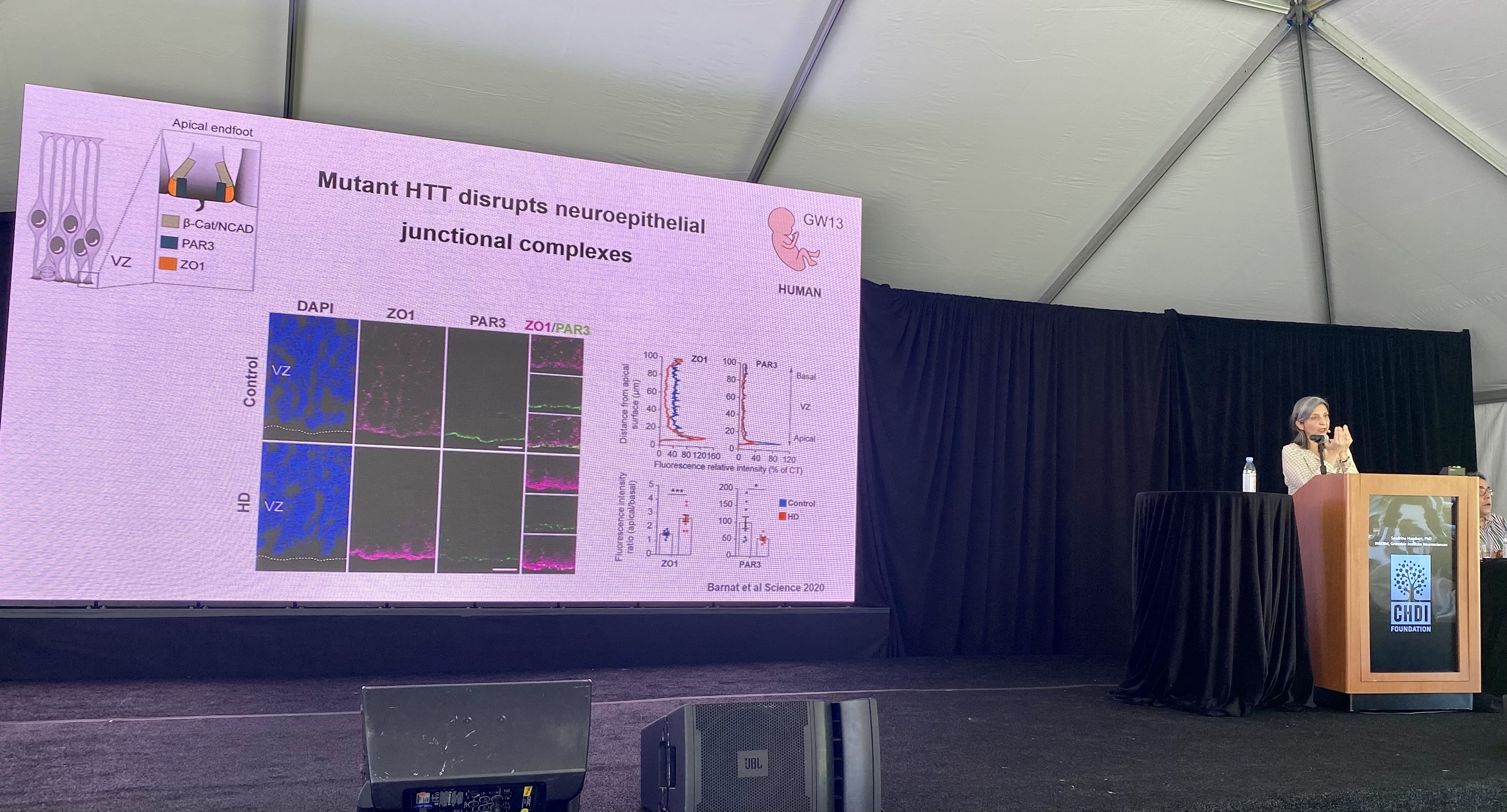
Premier intervenant de cette session : Sandrine Humbert de l’INSERM qui nous parlera de sa recherche sur le rôle de la protéine huntingtine au cours du développement cérébral. La protéine huntingtine a plusieurs tâches dans la cellule, dont l’une est consiste à déplacer différentes molécules dans la cellule. L’unes des molécules que la huntingtine aide à transporter dans les cellules nerveuses est le BDNF, lequel est important pour maintenir la santé des cellules cérébrales. Les deux formes de la protéine huntingtine, normale et expansée, sont fabriquées par les cellules aux tous premiers stades de la vie. Le laboratoire de Humbert pense que les erreurs commises par la forme expansée de la protéine huntingtine chez les personnes atteintes de la MH pourraient être responsables des symptômes dont elles souffrent plus tard dans la vie. Le laboratoire de Humbert a découvert que la huntingtine est importante pour de nombreuses fonctions dans le développement des cellules nerveuses, en ce compris la façon dont ces cellules sont initialement formées, leur structure finale et la façon dont elles fonctionnent et se connectent finalement avec d’autres cellules nerveuses. Chez les modèles murins MH sur lesquels le laboratoire Humbert travaille, ce développement ne s’effectue pas correctement, ce qui peut expliquer la neurodégénérescence observée plus tard dans la vie de ces souris. Nous avons publié au sujet de ces travaux (https://en.hdbuzz.net/290).
L’hypothèse du Dr. Humbert est que le changement dans la façon dont les cellules se connectent dans un cerveau MH les rend vulnérables plus tard dans la vie lorsque les patients MH développeraient généralement les symptômes.
Les derniers travaux de son laboratoire continuent d’explorer les rôles de la huntingtine dans la santé et dans la MH, y compris la façon dont la MH affecte la croissance, la structure et le mouvement des cellules nerveuses. La création de davantage de stabilité dans la structure des neurones, semblable à un échafaudage de soutien sur un immeuble, semble avoir plus tard des effets positifs sur leur santé.
En résumé, il semble que même si le développement des cellules nerveuses est différent chez les modèles MH, celles-ci sont très résistantes et les symptômes peuvent encore prendre des décennies à se manifester.
La huntingtine chez d’autres espèces
Prochain intervenant : Dr. Raffaele Iennaco de l’Université de Milan et de l’Institut national de génétique moléculaire dont les travaux utilisent les cellules souches afin de comprendre comment la structure du fragment exon 1 de la huntingtine affecte la fonction.
Le Dr. Iennaco travaille avec le laboratoire du Dr. Eléna Cattanéo, où elle se concentre sur l’utilisation de formes spéciales de cellules souches appelées « cellules souches pluripotentes induites » ou iPSCs. Ces cellules, provenant de patients MH, permettent à l’équipe d’étudier le tout début de la protéine huntingtine. Ce petit morceau reflète juste un tout petit peu de la protéine huntingtine – peut-être 3% environ de la protéine complète. Mais ce tout petit morceau joue un rôle démesuré dans les tâches de la huntigtine dans la cellule, en particulier dans la façon dont il se déplace dans la cellule.
Pour mieux comprendre cette petite partie de la protéine huntingtine, l’équipe de Iennaco a déterminé la séquence exacte de cette région chez 209 espèces animales différentes ! Cela augmente considérablement le nombre d’espèces pour lesquelles nous disposons de ce type d’informations.
Le nombre de CAG d’une espèce à l’autre varie beaucoup – chez le poisson, il semble toujours être de 4 CAGs, chez le lézard 5 alors que l’homme non porteur de la MH possède 17-20 répétitions CAG. La raison pour laquelle les différentes espèces ont besoin de quantités différentes de CAG est un grand mystère que Iennaco souhaite comprendre.
D’autres preuves issues des travaux de Iennaco suggèrent que le gène huntingtin est incapable d’accepter des mutations – il existe beaucoup moins de changements dans le code génétique de la huntingtine que ce à quoi on pourrait s’attendre par hasard. Preuve supplémentaire de l’importance du gène huntingtin. Chez les ouistitis (allez chez Google, c’est pour une expérience très mignonne), il existe en fait deux gènes huntingtin ! Ce n’est le cas dans aucune autre espèce étudiée mais cela suggère l’importance d’examiner plus de 200 espèces pour trouver des exemples d’évènements génétiques rares afin de mieux comprendre le gène huntingtin. En utilisant leurs cellules souches cultivées en laboratoire, l’équipe de Iennaco a pu étudier le lien exact entre la longueur de la zone de répétition CAG et la capacité de ces cellules à se développer en cellules cérébrales appelées neurones. Ces expériences nous aident à comprendre l’importance de toute la diversité génétique identifiée dans leurs études de séquençage.
Iennaco et son équipe se sont ensuite concentrées sur la comparaison entre la huntingtine de la souris et celle de l’homme. Etrangement, bien qu’elles soient très similaires, le gène huntingtin humain s’est révélé être plus toxique que la version de la souris, mais nous ne savons pas pourquoi. L’équipe est en mesure d’obtenir leurs cellules souches cultivées en laboratoire pour commencer à traverser les toutes premières phases du développement cérébral, ce qui leur permet d’étudier l’importance des petits changements (dans la longueur CAG ou entre les espèces) et d’évaluer leur impact sur le développement cérébral. En utilisant un système automatisé très cool, l’équipe a pris des images d’environ 5 000 mini-cerveaux différents dans le laboratoire pour mieux comprendre l’impact de minuscules changements dans la séquence huntingtine.
De nombreux aspects de la croissance de nouvelles cellules cérébrales, qu’ils ont évalués, étaient plus impactés par la huntingtine humaine que par celle de la souris, ce qui suggère qu’il existe quelque chose s’agissant de la séquence humaine qui la distingue dans sa capacité à être toxique pour les cellules cérébrales nouvellement nées. L’équipe s’est concentrée sur une zone très spécifique du gène huntingtin qui, selon elle, explique pourquoi les versions humaines du gène MH sot plus toxiques que celles des souris, ce qui confirme l’importance d’études génétiques comme celle-ci chez les animaux.
Les effets de la huntingtine sur les astrocytes
Prochaine présentation, celle du Prof. Baljit Khakh d’UCLA dont le laboratoire s’est intéressé à un type spécifique de cellule de soutien, appelé un astrocyte, dans le cadre de la MH. Ce ne sont pas les cellules les plus vulnérables dans le cadre de la MH (ce sont les neurones) mais le travail des astrocytes dans la vie consiste à soutenir les neurones. Bien que les astrocytes ne meurent pas au début de la MH, ils expriment définitivement le gène MH et ils présentent un certain nombre de changement dans leur forme et leur fonction lorsqu’ils expriment une copie mutante du gène MH. Le laboratoire de Khakh veut savoir si ces changements dans les astrocytes ont un impact sur la maladie de Huntington. Il a commencé ses travaux en examinant d’énormes ensembles de données générés à partir des cerveaux de patients MH et de modèles animaux, montrant quels gènes sont activés et désactivés, afin de rechercher des indices sur un éventuel mauvais fonctionnement des astrocytes. Cela semblait être le cas. Il y a des changements dans les astrocytes dans le cerveau des patients MH mais ont-ils de l’importance pour l’évolution de la MH ou reflètent-ils simplement des changements dans d’autres types de cellules ?
Un outil très cool de diminution de la huntingtine, appelé un « doigt de zinc » peut arrêter l’expression du gène huntingtin mutant. Nous avons publié à propos des ZFPs, que vous pouvez lire ici : https://en.hdbuzz.net/275.
L’équipe d’UCLA a pu développer des virus qui délivrent ces charges utiles réduisant la huntingtine aux différents types de cellules cérébrales, en ce compris les neurones ou les astrocytes. Cela lui permet de réduire le gène huntingtin dans différents types de cellules. Ces nouveaux virus réduisent très bien les taux du gène huntingtin seulement dans un type ciblé de cellule, de sorte que l’équipe est en mesure de poser des questions spécifiques sur la relation entre l’expression huntingtine dans des cellules particulières et les symptômes de type MH chez les souris. L’arrêt de l’expression du gène huntingtin mutant dans chaque type de cellule a sauvé bon nombre de changements observés dans ce type de cellule. Lorsque l’expression du gène huntingtin est arrêtée dans les neurones (type de cellule malade dans le cadre de la MH), ils ont observé des améliorations dans les astrocytes (les cellules de soutien !). C’est bizarre ! Cela suggère que se produit une sorte de boucle de rétroaction entre les cellules de soutien malades et les neurones malades dans le cerveau MH. Cela montre également le pouvoir de manipulation des types de cellules spécifiques (les choses ne sont pas toujours comme nous le supposons). L’équipe s’est ensuite posé la question : qu’advient-il aux symptômes de type MH chez des souris MH si l’expression du gène huntingtin est diminuée dans les astrocytes ou les neurones en utilisant un ZFP ? De nombreux symptômes étudiés ont été améliorés en supprimant le gène huntingtin mutant dans les neurones mais moins lorsqu’ils l’ont supprimé dans les astrocytes.
C’est très important – Khakh aime les astrocytes et voulait comprendre s’ils étaient à l’origine des symptômes MH. Ils ont réalisé un très bon ensemble d’expériences et ont constaté que les astrocytes sont modifiés mais les modifications dans les neurones demeurent le facteur le plus important, à la lumière de leurs résultats.
Traitement du message huntingtin
Prochain intervenant : José Lucas du CBMSO (Center of Molecular Biology Severo Ochoa) qui parlera de la façon dont est traité le message huntingtin et de la façon dont cela diffère chez les personnes atteintes de la MH.
Le processus par lequel les messages génétiques sont traités est appelé épissage. Ce sujet a surgi dans quelques discussions antérieures qui ont également étudié ce processus, et on pense que l’épissage crée le fragment exon 1 toxique de la hutingtine. L’épissage tourne mal dans divers autres maladies, de sorte que comprendre les similitudes dans ce processus entre les maladies pourrait aider à répondre aux questions concernant la MH et les symptômes observés chez les patients, tels que la perte des cellules nerveuses. Lucas et ses collègues ont cherché à voir quels sont les gènes affectés par les changements dans le processus d’épissage dans le cadre de la MH. Si le message d’un gène est épissé de manière incorrecte, cela signifiera souvent que moins de produit protéique complet de ce message sera fabriqué. Les scientifiques du laboratoire Lucas ont montré que s’ils activaient artificiellement un gène appelé RBFOX1, ils pourraient améliorer les symptômes chez un modèle murin MH en aidant à corriger les erreurs d’épissage. Peut-être que cette idée pourrait être utilisée pour aider à concevoir de nouveaux médicaments pour traiter la MH ?
Les messages génétiques sont également traités pour supprimer une « queue » dans leur séquence de code génétique, laquelle est composée de plusieurs lettres A se répétant encore et encore. Il s’avère que chez les modèles MH, de nombreux messages gardent leur « queue » plus longtemps qu’ils ne le devraient, ce qui affectera la façon dont ils sont transformés en leurs produits protéiques. L’une des protéines la plus affectée découverte dans cette recherche a conduit les scientifiques à découvrir que les personnes atteintes de la MH ont moins d’une vitamine appelée thiamine. Ils ont confirmé cela en évaluant les taux de thiamine dans le liquide céphalo-rachidien, constatant des taux réduits. Les scientifiques cherchent maintenant des réponses en clinique à deux questions différentes : les taux de thiamine pourraient-ils être utilisés comme biomarqueur de la progression de la MH ? Et un traitement de thiamine peut-il améliorer les symptômes chez les personnes MH ?
Bien qu’il s’agisse de vitamines couramment disponibles sur lesquelles le groupe Lucas se penche, des essais cliniques étroitement contrôlés sont nécessaires pour obtenir des réponses concluantes. Nous espérons avoir bientôt des mises à jour pour vous sur la façon dont ce possible traitement pourrait fonctionner chez les personnes atteintes de MH.
Contrôle de la dégradation de la protéine huntingtine
Pour conclure les exposés de ce jour, le Dr. Michael Rapé du Howard Hughes Medical Institue de l’Université de Berkeley en Californie, parlera de ses travaux sur la façon dont est dégradée la huntingtine dans la cellule et comment elle pourrait être utilisée pour traiter la MH. Le laboratoire Rapé recherche des petites molécules qui peuvent être utilisées afin de cibler la protéine huntingtine afin de la machinerie cellulaire la décompose et l’élimine, un processus connu sous le nom de dégradation de protéines.
Il existe certaines protéines dans la cellule qui étiquette d’autres protéines aux fins de dégradation. Ainsi, si on peut contrôler ce processus, on pourrait contrôler les protéines que la cellule dégrade. Cela serait formidable pour une maladie comme la MH où nous voulons réduire ou éliminer la protéine toxique. L’un des défis des thérapies pour les maladies cérébrales consiste à franchir la barrière hémato-encéphalique, la barrière sélective qui protège le cerveau des éléments nocifs dans le sang. Les médicaments que développe le laboratoire Rapé sont petits par rapport aux ASOs (comme ceux développés par les compagnies Roche et Wave) mais ils restent gros par rapport à la plupart des molécules médicamenteuses.
Heureusement, les scientifiques ont montré que les petites molécules dégradantes peuvent passer de la circulation sanguine au cerveau, ce qui est une excellente nouvelle pour les chercheurs qui veulent concevoir des dégradeurs pour des traiter des maladies comme la MH.
Nos cellules fabriquent plusieurs protéines différentes, appelées Ligases E3, lesquelles sont utilisées pour « étiqueter les déchets » dans la cellule et les cibler aux fins de dégradation. Si nous pouvions trouver une ligase E3 qui étiquette la protéine huntingtine, nous pourrions l’exploiter pour développer une molécule dégradante. Le laboratoire Rapé a développé un crible qui lui permettrait d’identifier des ligases E3 qui seraient de bonnes cibles. Ils ont identifié une ligase E3 appelée RNF126, laquelle semble avoir toutes les caractéristiques souhaitées pour le développement d’une molécule dégradant la huntingtine exploitant RNF126. Ils ont ensuite testé si RNF126 pouvaient spécifiquement dégrader la protéine huntingtine. Ils ont constaté que lorsque l’expression de RNF126 était augmentée, cela entraînait la dégradation de protéine toxique dans les cellules.
Mais ces expériences sont réalisées avec juste un fragment de la huntingtine expansée nocive. Que se passe-t-il lorsque les mêmes expériences sont réalisées avec une longueur complète de la protéine huntingtine avec une répétition CAG expansée ? Les résultats se répliquent ! Ensemble, ces données suggèrent qu’ils ont pu trouver l’aiguille dans la botte de foin – l’enzyme parfaite qui se lie à la huntingtine pour permettre naturellement sa dégradation dans les cellules afin d’empêcher l’agrégation des protéines, responsable de la maladie.
Les prochaines étapes consistent à faire avancer RNF126 dans le développement de médicaments pour tenter d’identifier un composé appelé glue moléculaire, lequel force RNF126 à aider à dégrader la protéine huntigtine. Nous attendons avec impatience de voir quelles sont les prochaines étapes pour cette molécule passionnante !
Restez connectés pour plus de nouvelles !
C’est tout pour aujourd’hui, les amis. Nous faisons une pause pour la nuit, mais nous serons de retour demain matin pour poursuivre les mises à jour de la recherche axées sur des approches innovantes pour les thérapies MH !
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…


