La conférence thérapeutique 2023 sur la maladie de Huntington – Jour 1
Découvrez les mises à jour de la recherche du premier jour de la conférence thérapeutique 2023 #HDTC2023
Bonjour de Dubrovnik en Croatie où se tiendra la conférence thérapeutique CHDI du lundi 24 avril au jeudi 27 avril 2023 !
Bonjour de Dubrovnik en Croatie où se tiendra la conférence thérapeutique CHDI du lundi 24 avril au jeudi 27 avril 2023.
Cette conférence est importante pour les chercheurs MH du monde entier, issus des industries, du milieu universitaire et d’organisations à but non lucratif. Des dizaines de scientifiques donneront des conférences sur tout ce qui concerne la maladie de Huntington, de la génétique à la thérapeutique en passant par l’actualité sur les nouveaux essais cliniques.
L’équipe éditoriale de HDBuzz sera sur place dès le mardi 24 avril au matin, en tweetant en direct des conférences scientifiques et des mises à jour sur l’avancement des essais cliniques. Nos mises à jour Twitter sont compilées ci-dessous. Continuez à suivre les mises à jour en direct pour le reste de la conférence avec le hashtag #HDTC2023.
Pour un résumé de la conférence de l’année dernière, commencez ici : https://en.hdbuzz.net/320. Nous publierons des résumés sous forme d’articles pour chaque jour de la conférence.
Savoir ce que nous devons savoir
Le premier exposé de la matinée est celui du Dr. Vahri Beaumont de la Fondation CHDI qui présentera un aperçu de ce que nous ne comprenons toujours pas s’agissant de la maladie de Huntington et de ce que nous devons savoir pour mieux développer des thérapeutiques. Elle parle tout d’abord de l’histoire de notre compréhension de la génétique MH et des changements cérébraux, des répétitions CAG, jusqu’à la perte des cellules et des circuits cérébraux, que les scientifiques ont appris à comprendre grâce à l’étude des dons de tissus cérébraux humains et à l’imagerie cérébrale.
Nous savons, depuis un moment maintenant, que les personnes atteintes de la MH ayant le même nombre de CAG peuvent commencer à présenter des symptômes à différents âges. L’une des raisons de cela est l’existence d’autres différences génétiques dans le code ADN d’une personne. Les scientifiques étudient ces changements de lettres ADN pour mieux comprendre comment ils pourraient modifier l’âge d’apparition de la MH et pourraient également être exploités pour mettre au point de nouveaux médicaments pour la MH. Beaucoup de ces autres différences génétiques affectent « l’instabilité somatique » dans laquelle la mutation CAG, responsable de la MH, mute encore plus loin dans certaines cellules cérébrales, devenant encore plus longue. De longues répétitions CAG dans le gène huntingtin conduisent à une protéine huntingtine expansée qui, avec le temps, peut être toxique pour différentes parties des cellules cérébrales. Vahri nous rappelle qu’il y a encore beaucoup de choses que nous ne comprenons pas s’agissant de la séquence précise des événements qui relient l’expansion du gène huntingtin aux symptômes que présentent les personnes atteintes de la MH.
Par exemple, nous ne savons toujours pas avec exactitude quel produit du gène huntingtin est l’acteur clé dans la maladie – s’agit-il de la molécule messager ? La protéine ? L’accumulation de protéines ? Peut-être qu’ils jouent tous un rôle dans la MH. Une autre question restant sans réponse : la « mauvaise » copie de la huntingtine gâche-t-elle les choses ou la perte d’une « bonne » copie laisse-t-elle les cellules cérébrales sans certaines fonctions. Indépendamment de ces questions, plusieurs approches thérapeutiques, ciblant la génétique MH, sont déjà testées en clinique. Certaines se concentrent sur la huntingtine dans sa totalité, la normale et l’expansée ; d’autres ciblent uniquement la forme expansée. Bonne nouvelle : il existe de nombreuses entreprises différentes testant tous types d’approches en clinique, ainsi que de nombreuses hypothèses différentes. Une combinaison de ces thérapies pourrait peut-être être le meilleur moyen de traiter la MH. Grâce à la générosité des personnes atteintes de la MH qui ont fait un don de cerveau après leur décès, les scientifiques continuent de réaliser des percées pour comprendre la maladie chez les personnes, en utilisant ces très précieux échantillons de tissus.
Les scientifiques utilisent les technologies les plus avancées pour comprendre ce qu’il se passe avec les messages et la protéine huntingtine dans différents types de cellules et pourquoi certains types pourraient être plus vulnérables. En utilisant différents types de modèles animaux, les chercheurs élaborent une meilleure image de ce qu’il se passe à l’intérieur du cerveau au cours de la MH et de la manière dont on pourrait intervenir. Les modèles animaux permettent également de tester des interventions, comme des médicaments à des stades très précoces de la MH.
Vahri précise qu’il existe certaines limites aux modèles murins, lesquels ne présentent pas tous les symptômes MH de l’homme. Les scientifiques continuent de développer et d’utiliser plusieurs modèles afin de mieux tester les médicaments avant qu’ils ne soient utilisés chez les personnes en clinique.
L’un des principaux objectifs de la recherche MH est d’être en mesure de commencer un traitement avant l’apparition des symptômes. Ce n’est pas facile mais un système de stadification très stratégique, le HD-ISS, aidera les scientifiques à y parvenir.
Le partage de données
Le Dr. David Howland de la Fondation CHDI présente la première séance officielle de partage de données de la conférence. Il se concentrera sur l’ADN huntingtin et sur la manière dont notre compréhension de sa structure peut éclairer le développement de thérapie.
Interruptions d’ADN
Le Dr. Galen Wright de l’Université de Manibota parlera de la manière dont de petites variations dans le gène huntingtin affectent l’évolution de la MH. L’année 2023 marque le 30ème anniversaire depuis la cartographie du gène huntingtin. Ce gène est TRES gros, bien plus gros que la plupart des autres gènes de notre corps, ce qui peut compliquer son étude par les scientifiques.
Galen récapitule ce que nous avons appris s’agissant du gène MH, de la tendance des répétitions CAG à se développer dans certaines cellules cérébrales au fil du temps (instabilité somatique) et d’autres gènes qui influencent cette expansion.
Trois lettres de l’ADN codent pour un seul acide aminé, élément constitutif des protéines. CAG codent pour la glutamine. Fait intéressant, les lettres CAA code également pour la glutamine et il s’avère que la plupart des personnes atteintes de la MH ont une « interruption » CAA dans leurs CAGs. Les personnes qui n’ont pas cette interruption CAA dans leur gène huntingtin présente la maladie beaucoup plus tôt dans la vie, même si la protéine codée par le gène est exactement la même. Cela survient très rarement mais cela suggère qu’il existe quelque chose dans le code ADN qui est important dans le cadre de la MH. Les scientifiques pensaient que ces interruptions CAA modifiaient la façon dont le gène huntingtin pouvait changer à travers l’instabilité somatique, mais il apparaît que ce n’est pas le cas ; ce qui signifie qu’il y a encore beaucoup de travail à faire pour comprendre ce qu’il se passe.
Lorsque des personnes réalisent le test prédictif, la longueur totale des répétitions CAG est mesurée. Bien que de petits changements de lettres de l’ADN puissent faire une grande différence s’agissant des symptômes MH, nous ne sommes pas au point pour mesurer cela chez les individus afin de comprendre leur probabilité d’apparition précoce ou tardive de la maladie. Fait intéressant, il existe d’autres maladies causées par des changements de lettres de l’ADN au sein du gène huntingtin, tel que le syndrome de Rett ou une autre maladie appelée Lomars. Ces maladies affectent également le système central nerveux, comme la MH.
L’équipe de Galen a extrait de grands ensembles de données ouvertes qui rassemblent des données d’associations de gènes provenant de nombreuses études différentes, pas nécessairement axées sur la MH. Ils ont découvert que le gène huntingtin est lié à des traits, tels que le vieillissement et les symptômes psychologiques. Ensemble, cela signifie que le gène huntingtin est probablement important dans beaucoup de rôles différents au sein de nos cellules nerveuses et que la biologie de la huntingtine est complexe. Galen souligne à juste titre que plus nous en apprenons, plus nous avons de questions au sujet de la huntingtine.
Dissection de la réparation de l’ADN
Prochain intervenant : le Dr. Anna Pluciennik de l’Université Thomas Jefferson. Son laboratoire étudie la façon dont les mutations se produisent dans notre code alphabétique de l’ADN et comment celles-ci peuvent entraîner la maladie. Les mutations sont causées par des dommages à l’ADN se produisant environ 50 000 fois par jour ! Nous avons développé de nombreuses façons de réparer l’ADN afin d’éviter une accumulation de mutations.
L’équipe d’Anna étudie un type spécifique de réparation de l’ADN, appelé réparation des mésappariements (réparation des défauts d’appariements de l’ADN), qui corrige une situation où deux brins de l’hélice d’ADN ne sont pas correctement appariés, de sorte que la structure de l’hélice est un peu bancale. Ces structures bancales sont reconnues par un mécanisme spécial qui peut alors essayer de résoudre ces problèmes pour corriger le code alphabétique de l’ADN. Ironiquement, dans certains cas (comme avec les répétitions CAG) ce mécanisme aggrave en fait les choses.
Le laboratoire d’Anna étudie la biochimie qu’elle compare au démontage d’une voiture en milliers de pièces afin de comprendre comment elles fonctionnent toutes ensemble, ce qui permet à son équipe de déterminer des détails qui ne peuvent pas nécessairement être observés dans des cultures cellulaires complexes ou chez des modèles animaux. L’équipe d’Anna crée, dans son laboratoire un proxy pour la mutation MH afin de comprendre comment le mécanisme de réparation pourrait la reconnaître et essayer de la réparer. Anna étudie l’expansion de répétitions CAG, qui peut les faire sortir de l’hélice de l’ADN, une structure connue sous le nom « d’extrusion ».
A l’aide de ce proxy, le laboratoire d’Anna dissèque quelles protéines de réparation de l’ADN font quoi. Ce type de dissection est important pour de futures études qui pourraient cibler de telles protéines avec des médicaments qui pourraient aider à traiter les personnes atteints de la MH. Les travaux d’Anna aident à comprendre comment différentes quantités de chaque protéines pourraient faire pencher la balance afin de déterminer si le mécanisme corrige les dommages à l’ADN, comme il se doit, ou empire les choses par inadvertance.
La structure de l’ADN influence la fonction
La dernière intervention de la matinée est celle du Dr. Natalia Gromak de l’Université d’Oxford, dont l’équipe étudie des structures spéciales appels R-loops, lesquelles peuvent être importantes dans le cadre de la MH. Les structures R-loops se forment lors de la création de l’ARN, copie messagère du code ADN. Si la copie ARN messager interagit avec l’ADN comme une fermeture éclair, cela forme une sorte de bulle dans l’ADN.
Ces structures jouent un rôle important dans certaines fonctions des cellules mais elles peuvent également interférer avec des éléments causant des maladies, de sorte qu’elles doivent être soigneusement équilibrées. Un lien a été fait très tôt entre les structures R-loops et les maladies neurodégénératives, dont la SLA. L’équipe de Natalia a généré une liste de protéines interagissant avec les structures R-loops dans l’espoir de comprendre leurs rôles en biologie et comment celles-ci pourraient mal tourner, causant des maladies. Plus de 50 maladies ont des séquences ADN répétitives qui sont expansées – tout comme la MH.
Le laboratoire du Dr. Gromak a découvert que des structures R-loops se forment dans des zones à ADN répétitive et ont étudié ces structures dans l’ataxie de Friedreich. Bien entendu, la question lors de cette conférence est de savoir si les structures R-loops jouent un rôle dans la maladie de Huntington. L’équipe de Natalia a découvert qu’il existait davantage de structures R-loops dans les cellules sanguines dérivées de patients MH et a trouvé le même résultat dans des neurones en culture porteurs de la mutation MH. Il y a également davantage de dommages à l’ADN dans ces deux types de cellules. Les prochaines questions pour l’équipe sont de savoir si des structures R-loops se forment sur une séquence répétitive du gène MH, si elles peuvent affecter l’expansion supplémentaire de cette zone (instabilité somatique) et si la diminution de la huntingtine a des effets sur les structures R-loops observées dans les cellules MH.
Technique CRISPR et maladie de Huntington
Le prochain intervenant, après la pause-café, est le Dr. Michael Brodsky de la faculté de médecine UMass Chan, dont le laboratoire utilise les technologies CRISPR, pouvant être déployées en laboratoire afin de réaliser des modifications très précises des séquences d’ADN génomiques. Cibler la cause racine de la MH, l’expansion CAG dans le gène huntingtin, est le moyen le plus sensé pour traiter la maladie mais cela est plus facile à dire qu’à faire. La modification de gènes serait un moyen d’y parvenir mais nous avons dû attendre que cette technologie rattrape son retard.
Il y a dix ans, tout cela n’était qu’un rêve mais les technologies se sont améliorées si rapidement que nous étudions maintenant très sérieusement la modification de gènes en tant que thérapie possible pour la MH, ce qui est très passionnant ! Michael précise que la modification de gènes est permanente, de sorte qu’il faut faire très attention pour s’assurer qu’il n’y a pas de changements involontaires. Autre défi pour l’usage de la modification de gènes dans le cadre de la MH : le médicament doit être administré dans les neurones, ce qui n’est pas une mince affaire. La modification de gènes doit être également très précise, ce qui signifie qu’idéalement, seul le gène huntingtin expansé est ciblé, de sorte qu’il y a peu ou pas de changements dans le gène huntingtin normal – également un défi de taille.
L’équipe de Michael adopte deux approches pour modifier le gène huntingtin expansé. La première consiste à cibler les petits changements alphabétiques (appelés SNPs) dans le reste de l’ADN du gène huntingtin qui ont tendance à être associés à la version expansée. Le laboratoire du Dr. Brodsky essaie tout d’abord ces expériences dans toutes sortes de modèles murins MH différents, dont les résultats suggèrent qu’ils sont en mesure de modifier spécifiquement le gène huntingtin expansé – une excellente nouvelle !
Une approche alternative pour modifier spécifiquement le gène huntingtin expansé consiste en fait à réduire la taille de l’expansion CAG pour la ramener à celle normale. L’équipe de Michael a réussi à le faire chez des souris MH et sur des cellules en culture. Il y a encore quelques problèmes à résoudre avant que cela puisse être développé en tant que traitement potentiel de la MH mais ils sont prudemment optimistes sur le fait que d’autres recherches aideront à définir une voie à suivre.
Davantage de CRISPR et maladie de Huntington
Le Dr. Ben Kleinstiver d’Havard/MGH portera également sur la modification de l’ADN. Il dirige un groupe de développement de technologie génomique qui travaille sur la façon de modifier l’expansion de répétitions CGA et éventuellement de créer des thérapies. Le laboratoire de Ben se concentre sur les nombreuses façons dont de la technologie CRISPR peut être utilisée pour apporter différents types de modification à l’ADN. Ils conçoivent les mécanismes CRISPR afin d’adapter encore plus ces modifications.
Sa principale question de recherche est la suivante : « quels outils de modification du génome peuvent être utilisés pour modifier ou raccourcir les répétitions CAG ? ». Le laboratoire adopte différentes approches pour couper les répétitions, les interrompre ou pour replacer des lettres ou séquences ADN uniques. Dans la mesure où la technologie CRISPR a évolué comme un moyen pour les bactéries de combattre des attaques de virus, il existe toujours certaines limites à l’utilisation de cette technologie pour traiter des maladies. Le groupe de Ben travaille pour surmonter ces limites afin de permettre un meilleur accès aux différentes parties du gène MH. Les techniques comprennent l’utilisation de différents types d’enzymes coupant l’ADN ou remplaçant les lettres, et l’application de différentes méthodes pour les diriger vers les séquences ADN. Ils mesurent ensuite pour voir si les répétitions CAG raccourcissent. L’objectif est d’affiner la modification et de la personnaliser pour le gène huntingtine.
Il s’agit de la première conférence pour Ben ! Il est passionnant de voir comment les experts de la technologie CRISPR dirigent leurs efforts vers la MH. Au fur et à mesure que les technologies évoluent, nous espérons qu’elles pourront être appliquées à de futures thérapies humaines.
Encore plus sur la technologie CRISPR et la maladie de Huntington
Kathryn Woodburn de la compagnie Life Edit Therapeutics présentera la dernière intervention avant la pause déjeuner. Elle travaille sur des moyens de cibler la copie expansée du gène huntingtin avec les technologies de modification. La compagnie Life Edit Therapeutics examine comment différentes versions du mécanisme CRISPR, en particulier ceux découvertes dans les plantes, peuvent être utilisées pour personnaliser la modification du gène expansé huntingtin.
Leur approche pour traiter la maladie de Huntington consistera à utiliser des virus afin d’administrer leur mécanisme de modification au cerveau. Jusqu’à présent, ils l’ont essayé chez différents types de modèles murins avec différentes versions et différentes doses de leurs médicaments de modification du gène. Ils ont été en mesure de réduire de 40% les taux de la protéine huntingtine nocive tout en laissant la protéine saine intacte ! Pour obtenir une spécificité du gène huntingtin expansé, leur approche consiste à cibler des signatures d’ADN spécifiques qui ne se trouvent que dans la version expansée du gène. La compagnie Life Edit Therapeutics examine quelques signatures différentes pour ce faire et jusqu’à présent, les données semblent prometteuses.
S’assurer qu’il n’y a pas d’effets indésirables hors cible est une tâche difficile et les scientifiques de la compagnie Life Edit Therapeutics s’efforcent de le résoudre le plus rapidement possible. C’est tout pour la séance du matin.
Sur les modificateurs génétiques dans le cadre de la maladie de Huntington
La séance de l’après-midi du premier jour portera sur les progrès réalisés dans l’étude des modificateurs génétiques MH.
Comprendre MSH3 dans le cadre de la maladie de Huntington
Des études génétiques humaines à grande échelle, connues sous le nom de GWAS, ont permis aux chercheurs d’identifier ces modificateurs génétiques, d’autres gènes influençant le début des symptômes MH. La première intervention est celle de Dan Felsen et Tasir Haque, scientifiques de la Fondation CHDI qui nous parlerons de leur gros effort d’équipe pour étudier un gène identifié dans GWAS, appelé MSH3, et comment ils pourraient être en mesure de concevoir des médicaments ciblant cette protéine.
MSH3, telles que vous vous en souvenez peut-être des précédentes discussions, reconnaît des morceaux d’ADN dépareillés qui doivent être corrigés. L’expansion CAG dans le gène huntingtin est susceptible de créer ces morceaux dépareillés et on pense que l’activité de MSH3 au niveau du gène huntingtin pourrait par inadvertance augmenter le nombre de répétitions CAG dans les cellules cérébrales (instabilité somatique). Les scientifiques pensent que MSH3 pourrait être une bonne cible pour des médicaments car la désactivation de ce gène semble être bénéfique dans des modèles animaux MH car elle réduit l’instabilité somatique – l’expansion du nombre de CAG – dans le gène huntingtin.
Désactiver complètement un gène est assez difficile à réaliser chez l’homme ; c’est pourquoi, à la place, les scientifiques mettent au point des médicaments dits « à petite molécule », lesquels pourraient potentiellement être administrés par voie orale et visant à empêcher MSH de fonctionner si bien dans les cellules. L’équipe de Dan a envisagé différents moyens pour inhiber MSH3 et créé une boîte à outils de matériels et de protocoles pour étudier leurs petites molécules. Cela aidera d’autres chercheurs qui espèrent mettre au point des médicaments ciblant MSH3. Pour fabriquer de meilleurs médicaments, il est utile de pouvoir « voir » la protéine MSH3. Il est possible de créer des modèles 3D de la protéine à l’aide de techniques astucieuses, et les scientifiques peuvent ensuite voir où est leur molécule et comment elle se lie.
Tasir Haque montre maintenant des animations qui zooment sur différentes parties de la protéine MSH3 et où les médicaments s’intègrent. Beaucoup de gribouillis qui ont une grande signification pour les biologistes structurels ! A l’aide de ces modèles, ils peuvent déterminer comment mieux améliorer ces molécules médicamenteuses à un stade précoce afin de mieux s’adapter à tous les coins et recoins de la surface de la protéine MSH3, ce qui devrait améliorer leurs propriétés.
Des médicaments ciblant MSH3
Prochain intervenant : Caroline Benn de la compagnie LoQus23 Therapeutics, une compagnie qui travaille également au développement de médicaments ciblant MSH3 – C’est un domaine brûlant ! La compagnie LoQus23 adopte une approche légèrement différente de celle du programme de la Fondation CHDI s’agissant de MSH3 – ils mettent au point des molécules qui ciblent une zone différente de la protéine Il s’agit d’une bonne nouvelle pour le domaine de la MH car c’est génial de pouvoir tester plusieurs approches ! Bien que leur approche consistant à cibler des zones différentes de la protéine MSH soit plus difficile, ils ont réussi et ont trouvé deux de ces séries de molécules qui sont très puissantes et sélectives, ce qui signifie qu’elles se lient très étroitement à la protéine MSH3 sans affecter les autres protéines.
La compagnie LoQus23 a également établi un moyen de mesurer l’instabilité somatique dans des cellules en culture afin de tester le bon fonctionnement de leurs molécules. Il s’agit d’expériences complexes qui prennent des semaines du début à la fin. Ils seront en mesure d’utiliser cette plateforme pour trouver de nouvelles cibles, en dehors de MSH3, jouant un rôle similaire dans cette partie de la réparation des dommages à l’ADN, si importante dans le cadre de la MH.
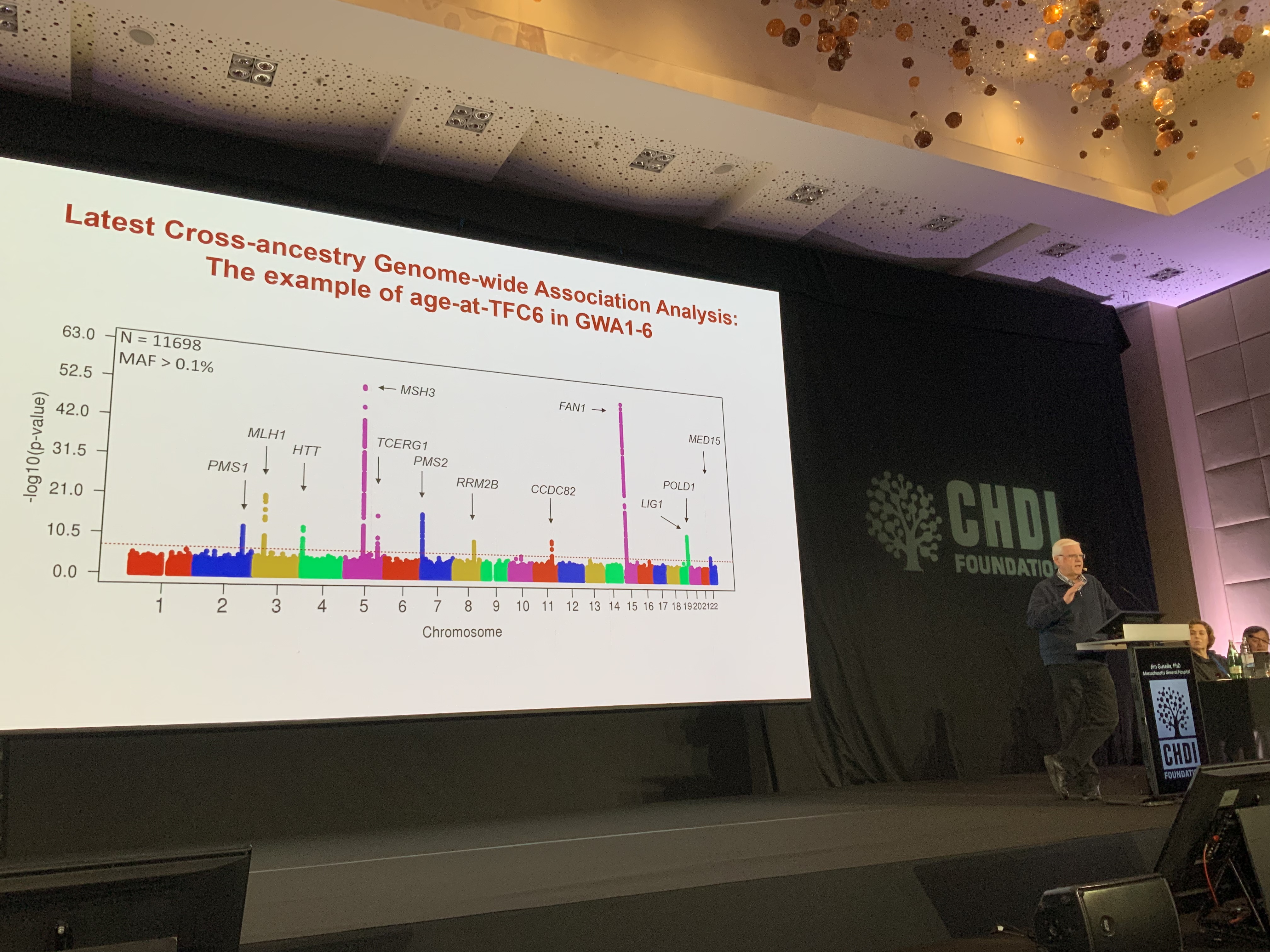
James Fleming de la compagnie Pfizer intervient ensuite. Cette compagnie développe également des médicaments pour cibler la voie impliquant MSH3. Elle adopte une approche similaire à celle de l’équipe de la Fondation CHDI, et comme d’autres, elle a développé une suite d’outils et de méthodes pour tester la capacité de leurs molécules à empêcher l’expansion des répétitions CAG.
Comme d’autres compagnies pharmaceutiques, la compagnie Pfizer adopte une série d’étapes pour dépister de potentiels composés médicamenteux, comprendre ils interagissent avec la protéine qu’ils ciblent, et ensuite les tester dans des cellules ou des animaux. Eux aussi utilisent des modèles 3D et des essais chimiques pour démontrer que leurs médicaments peuvent se lier au complexe protéique dont fait partie MSH3, ce qui les a aidés à améliorer ces molécules au fil du temps. La prochaine étape est de tester ces médicaments dans des cellules en culture. Une grande partie de ces travaux se concentrent sur les moindres détails de la chimie, de la structure et de l’énergétique des protéines. Beaucoup de mathématiques entrent dans le développement de médicaments !
Pour amener ces études chez les animaux, puis plus tard chez l’homme, il faudra un médicament possédant de bonnes propriétés : la capacité à cibler MSH3, la capacité pour le corps à le décomposer, et la capacité pour le médicament à pénétrer dans le cerveau. Pas une mince tâche ! Après avoir mieux compris les propriétés d’un nouveau médicament dans les cellules et animaux, l’innocuité de celui-ci sera ensuite testée chez l’homme. A l’heure actuelle, c’est un peu loin dans le futur pour tous les composés présentés aujourd’hui mais c’est passionnant de voir que les compagnies font avancer les travaux.
Des ensembles de données massifs pour identifier des modificateurs génétiques
Le coup d’envoi de la dernière séance de ce jour est donné par Jim Gusella de Harvard qui nous parlera des modificateurs génétiques dans la maladie de Huntington au nom d’un grand consortium de scientifiques qui étudient la génétique de la MH.
Jim commence sa présentation en saluant toutes les familles MH qui ont si généreusement partagé leurs données et échantillons avec les chercheurs MH au fil des ans et sans qui ces analyses à grande échelle ne seraient pas possibles. Une découverte intéressante, que l’on connaît depuis un certain temps maintenant, est que les personnes ayant le même nombre de CAG peuvent commencer à présenter des symptômes à des âges très différents. Les modificateurs génétiques sont des marqueurs dans l’ADN qui peuvent expliquer cette apparition précoce ou tardive des symptômes.
De plus en plus de preuves pointent vers un facteur particulier de l’apparition et de la vitesse avec laquelle la MH s’aggrave avec le temps : l’expansion des répétitions CAG dans certaines cellules. Ce processus, connu sous le nom d’instabilité somatique, semble être directement lié aux modificateurs génétiques. La puissance de ces études sur les modificateurs provient du nombre d’échantillons de patients analysés – davantage de données signifie des conclusions plus fiables. Dans l’étude la plus récente, les données de 11 698 participants ont été analysées, ce qui est incroyable !
Un problème avec la recherche MH, et la science en général, est que bon nombre d’échantillons analysés proviennent d’Européens ou de personnes d’origine européene. Dans ce dernier ensemble de données, l’équipe s’efforce d’inclure un groupe plus diversifié de patients dans les données. Avec une telle richesse et diversité de données, il est possible de faire un zoom arrière à grande échelle et de réaliser des prédictions générales sur la façon dont les modificateurs génétique (de minuscules changements au sein d’autres gènes) affectent le moment où les personnes atteintes de la MH pourraient atteindre certains stades de la MH.
Il est important de souligner qu’il s’agit d’un moyen d’avoir plus confiance dans les autres gènes affectant le plus la MH chez les personnes. Ceci est différent de la possibilité de prédire l’apparition ou l’évolution de la maladie chez un individu atteint de la MH. L’équipe de Jim et le consortium génétique ont également étudié comment de subtiles différences ou « interruptions » dans la séquence CAG au sein du gène huntingtin affecte la structure de l’ADN et la tendance des répétitions à devenir instables et à croître davantage. La bonne nouvelle de cet ensemble de données le plus récent est que MSH3, sujet de la précédente séance, est toujours un modificateur très important selon toutes les analyses par Jim et ses collègues. Cela donne beaucoup de crédibilité à toutes ces approches ciblant l’instabilité somatique et tentant d’empêcher l’expansion des répétitions CAG ou de la réduire.
Les expansions CAG dans des cellules cérébrales spécifiques
Nathaniel Heintz, de l’Université de Rockefeller, présentera ses travaux sur la compréhension des gènes activés ou désactivés dans le cadre de la maladie de Huntington. Le laboratoire de Heintz a développé une série de techniques permettant aux scientifiques de « trier » les noyaux de nombreuses cellules différentes et d’étudier les messages génétiques dans de nombreux types de cellules. C’est devenu un moyen important d’étudier pourquoi certaines cellules sont les plus vulnérables dans la MH et d’autres maladies. Ces analyses utilisent des échantillons de tissus cérébraux post-mortem, rendues possibles par l’incroyable générosité de la communauté MH.
Le striatum, une zone située au centre du cerveau, est le plus profondément affecté dans le cadre de la MH. L’équipe de Heintz est capable de trier différentes types de cellules dans le striatum et a découvert que l’expansion de répétitions CAG apparaît plus souvent dans un type de cellule, les neurones épineux moyens.
Nous savons depuis longtemps qu’un très grand nombre de neurones épineux moyens (MSNs) sont perdus dans le cadre de la MH. Il existe différents types de neurones épineux moyens et, curieusement, il apparaît que ceux qui sont vulnérables dans le cadre de la MH et ceux qui survivent sont sujets à une expansion de répétitions CAG. La raison pour laquelle ces neurones épineux moyens semblent avoir des taux d’expansions plus élevés pourrait être due aux taux plus élevés de protéine MSH3 que l’on trouve dans ces cellules mais ce lien n’est pas encore prouvé. Les neurones épineux moyens ont également un très grand nombre de gènes qui sont activés ou désactivés dans le cadre de la MH – 1 000 actifs et 500 inactifs ! De nombreux gènes affectés sont impliqués dans la réparation des dommages à l’ADN – renforçant encore une fois le rôle important que jouent probablement ceux-ci dans le cadre de la MH.
Des travaux en cours portent sur des questions de savoir quand les neurones épineux moyens sont affectés dans le cadre de la MH et comment intervenir au mieux. Ils examinent également d’autres zones cérébrales et analysent couche par couche pour comprendre avec exactitude quels types de cellules sont endommagés ou perdus.
Vitesse des expansions CAG
Le dernier intervenant de la journée est Steve McCarroll d’Harvard. Son laboratoire étudie quels gènes sont activés ou désactivés au niveau des cellules individuelles, au lieu d’un grand mélange de charges de différents types de cellules – une approche incroyablement détaillée. Il utilise une analogie avec des fruits pour parler de la puissance de cette technique – vous pouvez comparer des types de cellules comme différents types de baies ; le même type de cellule dans différentes personnes, comme des pommes avec des pommes ; les différences entre différentes cellules du même type, comme regarder deux myrtilles.
Ils peuvent, à partir de ces analyses de cellule unique, déterminer quelles cellules disparaissent au cours de la MH, confirmant les précédentes découvertes selon lesquelles les neurones épineux moyens et les neurones de projection épineux sont les types de cellules nerveuses les plus vulnérables. Ils peuvent également déterminer avec exactitude quelles cellules possèdent des expansions CAG – cela semble suggérer que les neurones épineux moyens vulnérables sont les plus susceptibles d’avoir davantage d’expansion. L’expansion CAG au cours de la vie d’une personne dans ces cellules semble être très spécifique au gène huntingtin UNIQUEMENT, et pas à d’autres gènes ayant des types similaires de code ADN. La majorité de ces cellules cérébrales vulnérable ont une expansion modérée de répétitions CAG mais un petit sous-ensemble a d’énormes expansions, dont les scientifiques n’ont pas encore tout à fait compris la raison.
Selon les données sur laboratoire de McCarroll, les expansions modérées semblent apparaître très lentement au fil du temps, mais les expansions les plus exagérées apparaissent plus rapidement. La question clé est de savoir à quel seuil du nombre de répétitions CAG, l’expansion s’accélère-t-elle, entrainant des dommages et la mort de ces cellules nerveuses vulnérables ? Pour essayer de comprendre cela, le laboratoire de McCarroll peut comparer les neurones individuels avec différents nombres de CAG, et les diviser en groupes pour mieux comprendre quelles longueurs sont les plus problématiques. Ils ont regroupé les cellules par nombre de CAG et étrangement, ils n’ont pas vu trop de différences dans les gènes activés et désactivés aux longueurs de répétitions différentes. Les changements les plus profonds se produisent dans les cellules avec des répétitions CAG très, très longues, plus de 180.
McCarroll propose une façon très différente de penser la pathologie MH et le fonctionnement de la maladie au fil du temps. Il y a des bavardages intéressants dans le public ! Mais c’est pourquoi il est si bon que tous ces scientifiques puissent se réunir lors de cette conférence pour débattre de toutes ces idées.
Rendez-vous demain !
C’est tout pour aujourd’hui, les amis. Nous faisons une pause pour la nuit, mais nous serons de retour demain matin ! N’oubliez pas de continuer à suivre les mises à jour en direct pour le reste de la conférence avec le hashtag #HDTC2023.
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…