Conférence thérapeutique CHDI sur la maladie de Huntington – 2023 Troisième jour
Consultez les mises à jour de la recherche du troisième jour de la conférence HD Therapeutics 2023 – #HDTC2023
Bienvenue au troisième et dernier jour de la recherche scientifique MH, en direct de Dubrovnik, en Croatie !
Nos mises à jour Twitter sont compilées ci-dessous. Continuez à suivre les mises à jour en direct du dernier jour de la conférence avec le hashtag #HDTC2023. Découvrez notre couverture du premier jour ici : https://en.hdbuzz.net/343 et du deuxième jour ici : https://en.hdbuzz.net/344.
Les biomarqueurs
La session du matin sera axée sur les biomarqueurs, des choses que nous pouvons mesurer pour obtenir une image de la santé de la personne ou de sa réaction à un médicament. Différents types de mesures par des biomarqueurs peuvent porter sur la prédiction de l’apparition, sur le suivi de la maladie de Huntington chez une personne ou sur la vérification de l’innocuité d’un médicament. Ainsi que nous en avons entendu parler hier soir, les taux NfL peuvent nous aider à obtenir une meilleure image de la santé du cerveau, mais d’autres protéines sont également étudiées à cette fin.
HD Clarity
Premier intervenant : Dr. Niels Henning Skotte de l’université de Copenhague qui nous parlera de ses travaux d’études portant sur des biomarqueurs à partir d’échantillons de patients MH. Il utilise des échantillons provenant d’une vaste étude de collecte de liquide céphalo-rachidien, appelée HD Clarity (https://hdclarity.net/). Niels parle tout d’abord de l’importance du « contrôle de la qualité » dans les échantillons de liquide céphalo-rachidien – des tests pour s’assurer qu’il n’y a aucune contamination et que les échantillons sont correctement stockés. Il a également présenté quelques statistiques pour montrer les quantités nécessaires pour répondre aux différents types de questions s’agissant de la maladie de Huntington. De nombreuses protéines, lesquelles sont de potentiels biomarqueurs, ne sont présentes qu’en infimes quantité dans les échantillons des patients.
Il existe des graphiques spéciaux, appelés « nuages de points » permettant aux chercheurs de voir quelles protéines présentes dans le liquide céphalo-rachidien diffèrent le plus entre les personnes porteuses du gène MH et les non-porteuses. Certains des biomarqueurs potentiels présentent même des différences entre les personnes non-porteuses du gène MH et celles porteuses présymptomatiques, ce qui pourrait être utile dans la chasse aux traitements pouvant être administrés avant l’apparition des symptômes. Lorsque certains taux de protéines diffèrent entre les personnes porteuses du gène MH et non-porteuses dans le sang et le liquide céphalo-rachidien, les chercheurs les examinent de plus près pour comprendre comment, et si possible pourquoi, leurs taux changent au cours des différents stades de la MH. Lorsqu’un changement de protéine est constant chez de nombreuses personnes, il peut être ensuite considéré comme un biomarqueur utile dans le cadre de la MH. Le rôle des différentes protéines dans le corps et la manière dont elles interagissent entre elles sont pris en considération, ce qui peut nous donner des indices sur les processus biologiques affectés dans le cadre de la MH.
A l’ère de l’intelligence artificielle, les scientifiques peuvent fournir de grands ensembles de données aux systèmes informatiques et leur demander de prendre en compte des ensembles complexes de facteurs afin de déterminer quelles protéines feraient les meilleurs biomarqueurs. Niels utilise des approches d’apprentissage automatique pour faire exactement cela. A l’avenir, la mesure des changements dans les groupes de nombreuses protéines avant le développement des symptômes, pourraient être utilisée pour mieux suivre une personne et savoir où elle se situe dans l’évolution de la maladie ou pour décider le moment où elle devrait débuter le traitement.
Des molécules de graisse comme biomarqueur de la maladie de Huntington
Le Dr. William Griffiths de l’université de Swansea nous expliquera comment le cholestérol et d’autres molécules de graisse pourraient être utilisés en tant que possibles biomarqueurs pour la maladie de Huntington. William nous rappelle qu’environ 25% du cholestérol de l’organisme est présent dans le cerveau, et qu’une grande partie de celui-ci est fabriquée sur place. Certains types de cholestérol sont capables de sortir du cerveau, de sorte que nous pourrions être en mesure d’évaluer leurs taux pour mieux comprendre la santé du cerveau. Une perturbation du processus de fabrication du cholestérol et les changements dans les taux de celui-ci ont été observés dans le cadre de la MH, et en fait, il existe des efforts de développement de médicaments axés sur la correction de ces changements.
Les travaux de William portent sur l’évaluation des différences entre les taux de cholestérol chez des personnes atteintes de la MH et des personnes saines pour voir si ces molécules pourraient être utilisées en tant que biomarqueur. L’évaluation et l’analyse des cholestérols nécessitent des techniques de biochimie sophistiquées. Les molécules spécifiques, qu’ils recherchent, sont difficiles à détecter, même avec un équipement haut de gamme disponible, ils ont donc dû peaufiner le système utilisant une technique appelée « chimie du clic ». Cela augmente le signal du cholestérol de la taille d’une herbe à la taille d’un arbre, ainsi que l’explique William. Son groupe a constaté qu’une forme de cholestérol, uniquement générée dans les neurones, est diminuée dans des échantillons sanguins de patients MH, ce qui en fait un biomarqueur potentiel.
L’instabilité somatique comme biomarqueur de la maladie de Huntington
Prochain intervenant : le Dr. Darren Monckton de l’Université de Glasgow qui nous parlera de son groupe de recherche portant sur la question de savoir si certains aspects de l’instabilité somatique pourraient être un biomarqueur de la maladie de Huntington.
Les scientifiques peuvent mesurer les taux de l’instabilité somatique de la partie répétée de CAG du gène MH dans tous les types d’échantillons de patients différents. Darren utilise des techniques de séquençage sophistiquées pour réaliser cela, aussi précisément que possible, dans l’ADN de dons sanguins de personnes atteintes de la MH. Le groupe de Monckton a cartographié la façon dont l’expansion de répétitions CAG change au fil du temps (instabilité somatique) à des taux différents dans les échantillons sanguins en fonction de l’âge de la personne et de son nombre initial de CAG.
Ils ont également examiné des échantillons sanguins d’un même individu, collectés à 7 ans d’intervalle. Cela donne des indices sur la manière dont l’instabilité somatique augmente chez chaque personne au fil du temps. Même au cours de cette énorme période, les changements sont généralement très subtils et se produisent lentement. Il est très important de pouvoir évaluer ces petits changements car les médicaments potentiels, qui modifieront le taux de l’instabilité, auront probablement aussi des effets très subtils.
Ces techniques seront probablement très utiles dans certains des essais cliniques en cours. La maladie de Huntington n’est pas la seule maladie présentant une instabilité somatique, et les techniques en développement dans le laboratoire de Monckton pour évaluer les changements subtils de l’ADN au fil du temps seront utiles pour l’étude d’autres maladies génétiques et des traitements correspondants, en dehors du domaine de la MH.
Suivi de la maladie de huntington par tomoscintigraphie par émission de positons (PET scan)
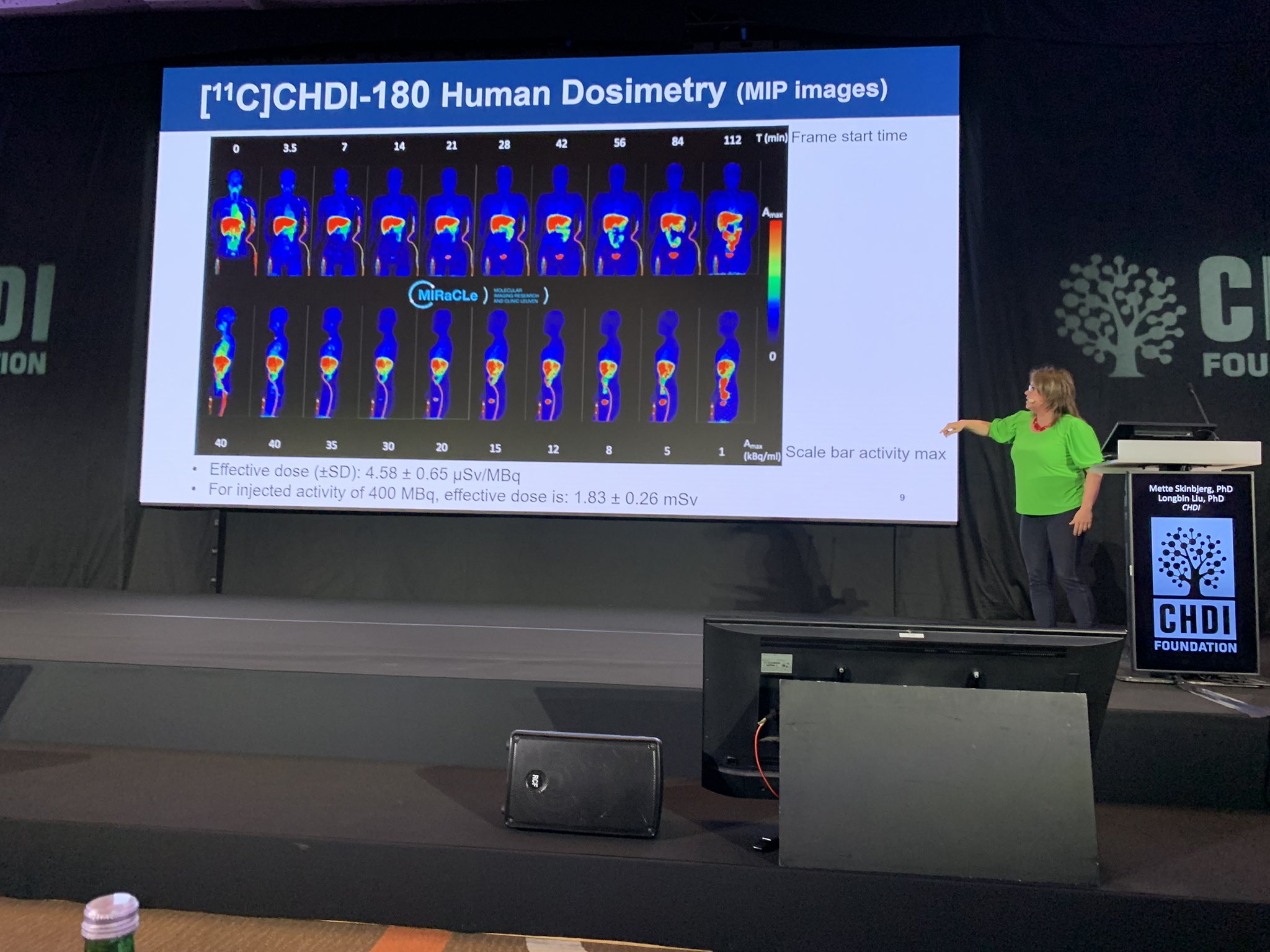
Nous sommes de retour après la pause-café et nous allons maintenant entendre le Dr. Mette Skinbjerg parler du traceur TEP huntingtin permettant de suivre les amas de protéines toxiques dans le cerveau, s’accumulant au fil du temps. Nous avons déjà publié à ce sujet ici. Sans traceur, le seul moyen de voir comment la protéine s’accumule dans le cerveau humain est d’examiner des échantillons post-mortem. Les traceurs sont un moyen sûr de regarder chez des personnes en vie et ceux-ci pourraient être un excellent moyen de voir comment des médicaments pourraient agir.
La Fondation CHDI a travaillé avec des partenaires universitaires pour mettre au point un traceur pour la maladie de Huntington qu’ils ont largement caractérisé dans de nombreux modèles animaux différents, incluant des souris et des singes, leur permettant de suivre l’accumulation des amas de protéines au fil du temps. Ils vont maintenant au-delà des modèles animaux pour tester leur traceur chez des personnes. Les traceurs sont marqués à la radioactivité afin que les scientifiques puissent évaluer où ceux-ci se collent à la cible – en l’espèce, les amas. Il est important que les traceurs quittent le corps après le dosage afin que l’exposition à la radioactivité soit dans la plage de sécurité.
Bien que le traceur semble être sans danger afin d’être utilisé chez l’homme, malheureusement, le signal dans le cerveau n’a pas suivi ce que les scientifiques avaient prévus. C’est décevant mais ce programme nous a beaucoup appris s’agissant de la mise au point d’un traceur pour la MH, laquelle pourra être utilisée pour en réaliser de meilleurs à l’avenir. L’équipe travaille maintenant sur une nouvelle génération de traceurs qui, espère-t-elle, fonctionneront beaucoup mieux. Les choses progressent en laboratoire avec de nombreux tests sur des animaux MH, alors espérons que le prochain cycle fonctionnera mieux.
Biomarqueurs et apprentissage automatique
Prochain intervenant : Dr. Peter Wijeratne de l’Université du Sussex, dont l’équipe vise à utiliser des biomarqueurs et l’apprentissage automatique (sous-catégorie de l’intelligence artificielle) pour caractériser et prédire l’évolution de la maladie de Huntington chez les individus. Très intéressant !
Alors que les chercheurs continuent d’identifier toutes sortes de biomarqueurs différents à partir de biofluides, d’imagerie, etc…, de nombreux biomarqueurs pour une personne pourraient être combinés afin d’obtenir de meilleurs prédictions. Mais la combinaison et la compréhension de toutes ces données ensemble est difficile à réaliser pour les personnes, c’est là que l’intelligence artificielle (IA) peut nous aider !
Peter a utilisé un exemple amusant de ChatGPT pour expliquer l’apprentissage automatique – un algorithme qui peut s’adapter et faire des déductions à partir de modèles de données. Il a montré avec quelle rapidité ces systèmes peuvent apprendre de nouvelles informations et prendre des décisions éclairées – très intéressant ! Pour « former » le système IA, on a besoin de beaucoup, beaucoup de données d’entraînement de haute qualité pour lesquelles les scientifiques connaissent déjà la réponse. Le système IA peut alors apprendre à repérer des modèles dans ces données, ce qui lui permet de repérer des modèles similaires et connexes dans les données de test où les réponses ne sont pas encore connues.
L’équipe de Peter examine les données d’imagerie cérébrale provenant de trois études différentes portant sur la façon dont les différentes structures cérébrales changent dans le cadre de la MH au fil du temps. En formant l’IA sur ces ensembles de données riches et complexes, ils espèrent être capables de réaliser des prédictions robustes s’agissant de la maladie. Ils s’avèrent que de bonnes prédictions s’agissant de l’apparition de la maladie ont été réalisées et les résultats concordaient bien avec le système de stadification HD-ISS. Ils espèrent que cela leur sera utile à l’avenir pour réaliser des prédictions au niveau individuel.
Les taux de huntingtine et le médicament Tominersen
Le Dr. Blair Leavitt, un clinicien/chercheur de l’Université de la Colombie-Britannique présentera son étude des échantillons provenant de l’essai GEN-EXTEND portant sur le médicament Tominersen. Il approfondit la façon dont les taux de huntingtine changent avec le traitement Tominersen.
Il commence par remercier les membres familiaux MH qui partagent généreusement et de manière désintéressée des échantillons biologiques avec les scientifiques afin de créer une ressource de biobanque. Ceci est inestimable pour les scientifiques afin de comprendre la maladie de Huntington et la façon avec laquelle les médicaments peuvent changer le chemin de cette maladie. Blair se concentre sur un individu en particulier, qui était très attaché au don de son cerveau après son décès. Un riche ensemble de données et de nombreux échantillons sont disponibles à partir des essais portant sur Tominersen, auxquels il a participé, ainsi que son tissu cérébral qui offre une rare fenêtre sur les effets des médicaments.
En examinant le cerveau, l’équipe de scientifiques de Blair a été en mesure d’évaluer les taux du médicament dans les différentes régions et de les comparer aux niveaux d’exposition prédits par de précédentes expériences sur les singes. En général, ceux-ci ont montré que les prédictions étaient plutôt bonnes. Ils ont ensuite examiné les taux de huntingtine dans les différentes zones du cerveau et comment ceux-ci se comparent aux cerveaux témoins. Comme prévu pour un traitement diminuant la huntingtine, les taux chez cette personne étaient bien inférieurs à ceux des personnes témoins. Malheureusement, les taux de huntingtine dans le liquide céphalo-rachidien étaient trop faibles pour être quantifiés chez cette personne. Ce qui signifie que nous ne savons pas dans quelle mesure les taux de huntingtine dans le cerveau et le liquide céphalo-rachidien sont corrélés, du moins pour ce participant à l’essai.
Il est difficile d’exagérer à quel point ce tissu est précieux pour que les scientifiques puissent vraiment examiner en profondeur la manière avec laquelle un traitement a affecté le cerveau. Les collaborateurs dans le public poseront des questions supplémentaires en utilisant ce tissu si généreusement offert par ce participant à l’essai.
Les essais cliniques
Nous sommes de retour après la pause-déjeuner pour la dernière session scientifique de la conférence. La session de l’après-midi portera sur les essais cliniques, et nous entendrons parler de la conception des études et des progrès de la recherche humaine.
Classement des stades de la maladie de Hutington
Le Dr. Jeff Long de l’Université de l’Iowa a parlé du système HD-ISS, un système de stadification pour la maladie de Huntington. Il s’agit d’un outil de recherche clinique permettant aux chercheurs de mieux classer les personnes aux premiers stades de la MH pour une conception des essais et un recrutement plus efficaces.
Maintenant que ce nouvel outil est largement utilisé, l’équipe de Jeff développe une base de données sur les informations issues de grands essais observationnels, tels que IMAGE-HD, PREDICT-HD, TRACK-HD et ENROLL-HD, afin de mieux comprendre l’évolution temporelle vers les stades du système HD-ISS. L’équipe de Jeff, ayant mis au point ces outils, cherche à comprendre comment ceux-ci pourraient être utiles dans le cadre d’un essai clinique – combien de patients MH, à un stade particulier de la maladie, seraient nécessaires pour générer des résultats solides pour nous convaincre si un médicament a agi ou non.
Depuis que le système HD-ISS incorpore des données issues d’images cérébrales, de biomarqueurs et de génétiques, de nombreuses variables peuvent être prises en considération pour définir les meilleures mesures cliniques à utiliser pour démontrer si un nouveau médicament pourrait agir. En utilisant des bases de données d’essais observationnels, des chercheurs, comme Jeff, peuvent appliquer des techniques statistiques afin de mieux prédire le nombre de participants et les types d’évaluations susceptibles d’être nécessaires afin de démontrer les avantages d’un médicament. Il s’agit de mathématiques complexes et importantes qui illustrent l’importance de la participation à la recherche observationnelle.
Les faits sont éloquents (ou les données)
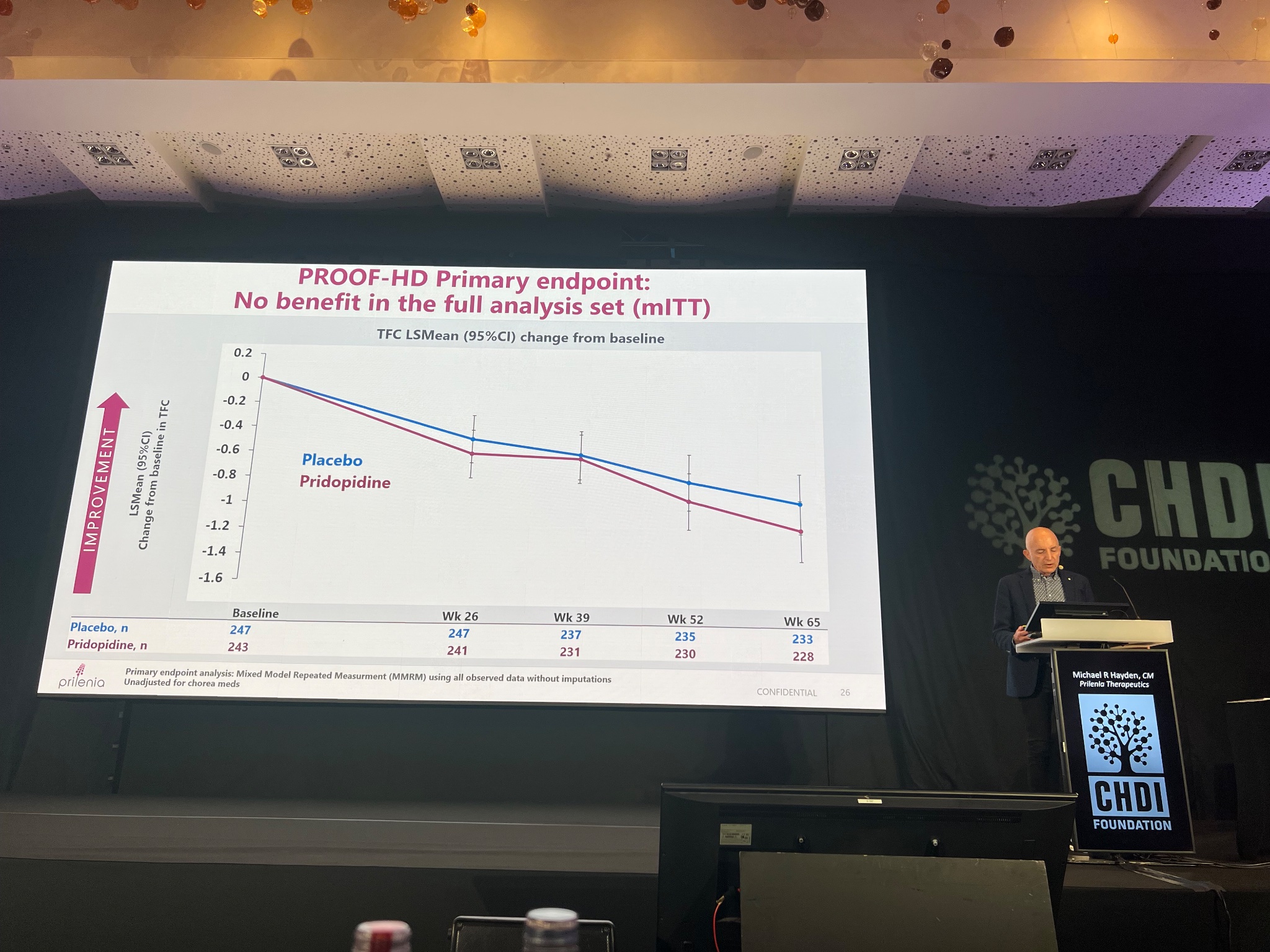
La prochaine intervention est très attendue et porte sur les tous premiers résultats de l’essai PROOF-HD concernant le médicament Pridopidine. Nous avons appris mardi dans la presse que l’essai n’avait pas atteint ses principaux critères d’évaluation, mais nous voyons maintenant les données.
Le Dr. Michael Hayden, PDG de la compagnie Prilenia, donne cette présentation. Il explique tout d’abord le mécanisme par lequel le médicament est censé affecter les cellules nerveuses, en particulier son action sur un type de récepteur qui facilite la communication entre les neurones, connu sous le nom de sigma 1.
L’essai PROOF-HD était conçu pour utiliser certaines évaluations cliniques, une combinaison de tests moteurs, comportementaux et cognitifs pour voir si le médicament Pridopidine aidait à ralentir l’aggravation des symptômes MH sur une période d’environ un an et demie. Les essais sont conçus avec des critères d’évaluation « principaux », « secondaires » et « exploratoires ». Montrer qu’un médicament affecte les critères d’évaluation principaux est généralement la façon dont les décisions sont prises pour continuer à développer le médicament et éventuellement à le faire approuver. Cet essai a recruté rapidement et la plupart des participants sont restés au sein de celui-ci pendant toute la période, un témoignage de la mobilisation et de l’engagement des patients MH. Lorsque la grande majorité de personnes poursuivent dans un long essai, cela peut également parler de sécurité et tolérabilité du médicament.
La principale conclusion globale est que les principaux critères d’évaluations n’ont pas été atteints. En l’espèce, il s’agissait d’une évaluation de la capacité des personnes à agir au quotidien. En moyenne, les personnes prenant le médicament et celles prenant le placebo ont fonctionné de manière similaire pendant toute la durée de l’essai. Un autre critère d’évaluation important était une combinaison de différentes évaluations motrices, comportementales et cognitives, et celles-ci ne se sont pas également améliorées pour les personnes prenant le médicament Pridopidine. Ce médicament aurait pu présenter certains avantages dans une évaluation motrice, appelées le Q-motor, mais cela n’était pas statistiquement significatif.
Lorsqu’un essai est conçu, mais avant qu’il ne débute, le promoteur (en l’espèce, la compagnie Prilenia) doit prendre des décisions s’agissant des types de statistiques et analyses qu’il effectuera une fois les résultats disponibles. Dans l’essai PROOF-HD, la compagnie Prilenia a décidé que les groupes de participants seraient séparés entre ceux prenant des médicaments appelés neuroleptiques (également connus sous le nom de neuropsychotiques) et ceux ne prenant pas de tels médicaments. En effet, le médicament Pridopidine affecte certaines des mêmes voies biologiques que les neuroleptiques. Lorsque la compagnie Prilenia a examiné uniquement les données de personnes ne prenant pas de neuroleptiques, le potentiel avantage était plus évident en utilisant certaines évaluations cliniques, en particulier lors de la première année. En fin de compte, cela n’était également pas statistiquement significatif.
Michael présente maintenant les données d’un essai portant sur le médicament Pridopidine chez les personnes atteintes de la SLA, une maladie présentant une biologie commune avec la maladie de Huntington. Cet essai a également montré certains avantages potentiels sur les critères d’évaluation secondaires.
La compagnie Prilenia pense que la Pridopidine reste prometteuse pour le traitement de la MH, et elle se concentrera maintenant sur l’approfondissement des données. Ils doivent notamment comprendre comment différents les traitements neuroleptiques affectent la réponse au médicament.
Feu rouge pour le médicament Branaplam
Le Dr. Beth Borowsky de la compagnie Novartis présente les résultats de leur essai portant sur un médicament appelé Branaplam chez des patients MH. Nous avons publié au sujet de ce médicament et de son surprenant mécanisme d’action.
Bien que le Branaplam ait été sans danger chez des enfants atteints d’une autre maladie (amyotrophie spinale), certaines études animales ont indiqué qu’il existait une possibilité de lésions des nerfs se projetant du cerveau vers la peau et les muscles du corps. La compagnie Novartis a, sur la base de cette préoccupation, inclus des experts spécialisés dans ce type de lésions nerveuses parmi les patients MH traités, juste au cas où un tel symptôme apparaîtrait au cours de l’essai.
Malheureusement, en quelques semaines, quelques subtils mouvements et des évaluations en laboratoire ont suggéré que les risques redoutés étaient réellement apparus. Lors de la consultation avec leurs experts indépendants de surveillance de la sécurité, la compagnie Novartis a décidé de suspendre initialement le dosage. Au moment de la pause, les patients avaient pris le traitement pendant 5 à 22 semaines. Après un examen minutieux, ils ont constaté que 78% des patients traités présentaient un ou plusieurs signes pouvant indiquer des lésions nerveuses, ainsi que des modifications des structures du cerveau appelées ventricules.
La compagnie a, sur la base d’une analyse très minutieuse des bénéfices et risques pour les patients, pris la décision d’arrêter l’essai au mois de décembre 2022. Nous avons publié à ce sujet ici. Actuellement, tous les participants à l’essai continuent d’être surveillés pour détecter les symptômes de lésions nerveuses et pour suivre comment cela peut changer au fil du temps après l’interruption du traitement.
Beth a apporté un aperçu des données que la compagnie Novartis a collectées pour informer la communauté MH de ce qu’elle a trouvé. Tout d’abord, comme espéré, le Branaplam a diminué les taux de huntingtine d’environ 25% dans le liquide céphalo-rachidien, suggérant que le médicament était capable de diminuer les taux de huntingtine dans le cerveau.
Malheureusement, la compagnie Norvatis a également constaté des taux plus élevés d’une protéine appelée neurofilament à chaîne légère, ou NfL, un marqueur des cellules cérébrales malheureuses. On a déjà parlé des NfL auparavant car ils augmentent dans le cours normal de la MH, et il s’agissait d’un gros sujet de la session portant sur les biomarqueurs lors de cette conférence. Nous espérons que si un médicament MH agit, les taux de NfL diminueront au fil du temps. Mais dans l’étude portant sur le Branaplam, la compagnie Norvatis a découvert que les taux de NfL dans le sang et le liquide céphalo-rachidien augmentaient avec le traitement. C’est l’une des conclusions qui a encouragé la compagnie Norvatis à suspendre l’étude.
Parallèlement à ces tests en laboratoire, les médecins procédaient à des études minutieuses de la fonction nerveuse chez chaque participant. Environ 86% des participants présentaient un type de symptôme neurologique et l’imagerie cérébrale a montré de plus grandes cavités remplies de liquide, appelées ventricules latéraux.
Tout ensemble, il semble que le médicament de la compagnie Novartis ait fait ce qu’ils pensaient qu’il ferait – réduire les taux de huntingtine dans le cerveau. Malheureusement, cela s’est accompagné d’effets secondaires graves, de sorte qu’il n’y a pas de voie sûre pour ce médicament. Il est important de noter que la compagnie Novartis continue de surveiller les participants à l’essai et d’analyser les données pour éclairer le développement de médicaments à l’avenir.
Le médicament AMT-130 avance
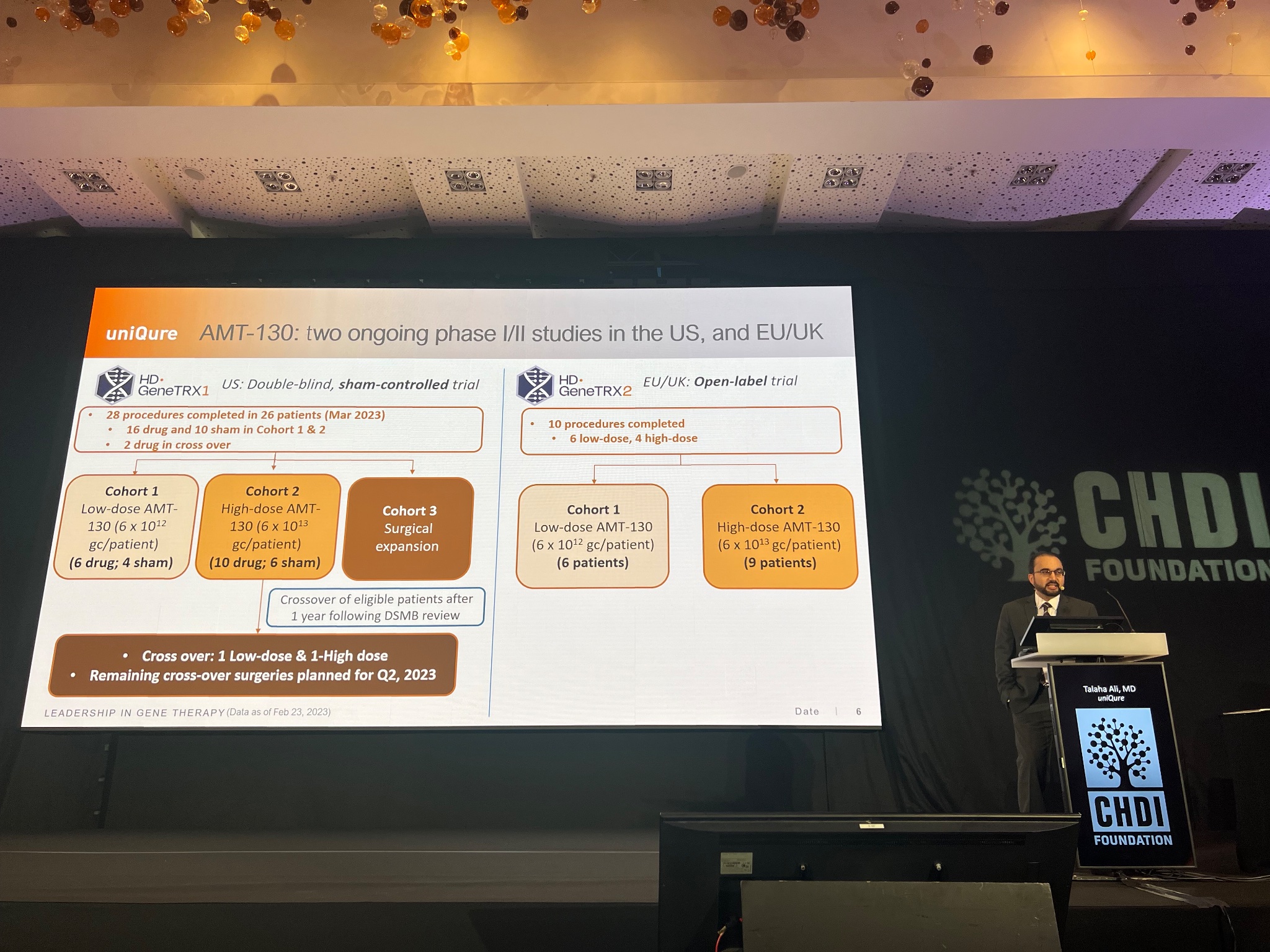
Prochain intervenant, le Dr. Talaha Ali de la compagnie UniQure qui présente une mise à jour de leur étude portant sur une thérapie génique MH appelée AMT-130. Celle-ci repose sur l’injection de virus inoffensifs comportant des instructions pour apprendre aux cellules cérébrales la manière de réduire les taux de huntingtine.
L’incroyable chose à propos de ces thérapies à base d’un gène viral est qu’elles nécessitent théoriquement qu’une seule injection car les virus persistent dans le cerveau pendant de nombreuses années – peut-être à jamais. L’inconvénient de celles-ci est qu’elles nécessitent une chirurgie afin d’administrer les virus dans le cerveau. Cette approche chirurgicale est testée dans deux essais distincts – un aux Etats-Unis et un en Europe. Dans la mesure où cela est tellement avant-gardiste, seul un petit nombre de personnes sont incluses – environ 40 patients au total.
Dans cet essai, les patients reçoivent très minutieusement, très lentement l’injection du médicament dans différentes parties des structures profondes du cerveau, qui sont le plus impactées dans le cadre de la MH. L’essai teste une faible dose et une dose élevée de l’AMT-130 et surveille de près les participants pendant la première année et ensuite plus fréquemment jusqu’à cinq ans. La compagnie UniQure partagera bientôt de nouvelles données et mises à jour, vers la fin du mois de juin 2023.
Comme indiqué précédemment, la compagnie UniQure a, en cours de route, eu des réactions préoccupantes chez trois patients. Après un examen minutieux, les médecins indépendants surveillant ces symptômes sont décidé que le risque semblait acceptable et l’essai s’est poursuivi.
Plus passionnant, la compagnie UniQure a des preuves selon lesquelles l’AMT-130 réduit les taux de huntingtine dans le liquide céphalo-rachidien, mais à ce jour, le nombre de patients traités est trop petit pour effectuer des estimations précises. Espérons que des données plus intéressantes viendront la prochaine fois que nous entendrons parler de la compagnie UniQure !
Réduire les objectifs pour le médicament Tominersen
Le Dr Peter McColgan de la compagnie Roche, laquelle développe un médicament appelé Tominersen pour la maladie de Huntington, parlera de l’histoire du programme, de ce que nous avons appris des essais portant sur ce médicament et de ce qu’il va se passer avec l’essai GENERATION HD2 en cours.
La compagnie Ionis a initialement développé le médicament Tominersen, un médicament génique administré par la moelle épinière, appelé un ASO. Au début de courts essais d’innocuité, il s’agissait du premier médicament capable de diminuer les taux de huntingtine chez l’homme. Cela a été suivi par un très vaste essai aux fins de tester les effets sur les symptômes MH (étude GENERATION HD1). On a appris au mois de mars 2021 que l’étude GENERATION HD1 était interrompue pour des raisons de sécurité – le médicament n’aidait pas les patients MH et à forte dose, il pouvait causer du mal.
Plus tard, la compagnie a approfondi les données et a constaté que certains participants de l’étude GENERATION HD1 avaient peut-être bénéficié du Tominersen, en particulier ceux qui ont commencé l’essai à un âge plus jeune et avec des symptômes moins sévères. La compagnie Roche a, pour cette raison, mis au point et lancé l’essai GENERATION HD2, lequel est une étude plus petite testant le médicament chez une population d’individus plus jeunes et se situant aux tous premiers stades de la MH. Cette étude recrute actuellement et à terme, il y aura 75 sites dans 15 pays.
Peter présente maintenant des données sur NfL, une protéine pouvant servir de marqueur s’agissant de lésions aux cellules nerveuses. De nouvelles analyses de données issues de l’étude GENERATION HD1 montre que la prise de Tominersen à des doses plus faibles est probablement plus sûre, sur la base de niveaux plus faibles de NfL. L’essai GENERATION H2 teste deux doses différentes plus faibles du médicament, et la modélisation mathématique prédit que ces doses plus faibles seront plus sûres car elles n’entraîneront pas une grande augmentation de NfL.
Peter partage maintenant de nouvelles données sur NfL s’agissant de l’essai GENERATION HD1. Vers la fin de l’essai, il semble en fait que les niveaux de NfL diminuent avec le Tominersen, ce qui est une preuve supplémentaire que les doses plus faibles testées dans l’étude GENERATION HD2 pourraient être prometteuses.
Voici la présentation complète de Peter sur tominersen.
Ceci conclut les discussions sur la recherche scientifique lors de la conférence HD Therapeutics 2023. Merci d’avoir suivi et visitez http://hdbuzz.net pour lire les résumés des trois jours !
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…