
Silenciation génique pour la maladie de Huntington : le point sur la situation
La silenciation génique est-elle aussi prometteuse qu’elle n’y paraît pour la maladie de Huntington, et quel pourrait être l’avenir ?

Attention : Traduction automatique – Possibilité d’erreurs
Afin de diffuser le plus rapidement possible les actualités relatives à la recherche sur la maladie de Huntington et les dernières informations sur les essais cliniques au plus grand nombre, cet article a été traduit automatiquement par une intelligence artificielle et n’a pas encore été révisé par un éditeur humain. Bien que nous nous efforcions de fournir des informations précises et accessibles, les traductions effectuées par une intelligence artificielle peuvent contenir des erreurs grammaticales, des interprétations erronées ou des formulations peu claires.Pour obtenir les informations les plus fiables, veuillez vous référer à la version anglaise originale ou revenez plus tard pour consulter la traduction entièrement révisée par des humains. Si vous remarquez des problèmes importants ou si vous êtes un locuteur natif de cette langue et que vous souhaitez nous aider à améliorer la précision des traductions, n’hésitez pas à nous contacter à l’adresse editors@hdbuzz.net.
La silenciation génique consiste à utiliser des molécules spécialement conçues pour « désactiver » le message qui fait que les cellules produisent la protéine huntingtine nocive. Notre guide HDBuzz sur la silenciation génique explique les techniques, les résultats obtenus jusqu’à présent et les défis à venir.
Nous avons reçu de nombreuses demandes de lecteurs pour écrire un article sur la « silenciation génique », également connue sous le nom de « silenciation de la huntingtine ». C’est un domaine de recherche qui suscite beaucoup d’enthousiasme. L’attention de nombreuses personnes a été attirée sur le sujet par le récent communiqué de presse conjoint de Lundbeck et de l’Université du Massachusetts, annonçant une collaboration de recherche visant à développer des thérapies d’« interférence ARN (ARNi) » pour la maladie de Huntington.
Alors, qu’est-ce que la silenciation génique ? Comment cela fonctionne-t-il et comment cela pourrait-il profiter aux patients atteints de la maladie de Huntington ?

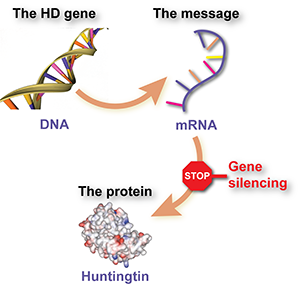
Gènes, messages et protéines
Les protéines sont des molécules qui agissent comme de minuscules machines, effectuant la plupart des tâches utiles à l’intérieur des cellules, comme faire fonctionner les réactions chimiques, communiquer des messages, donner aux cellules leur structure, etc. Chaque protéine différente est fabriquée à l’aide d’un ensemble d’instructions appelé gène. Les gènes sont constitués d’ADN et vivent dans le centre de contrôle de la cellule, le noyau.
Cependant, les gènes ne sont pas utilisés pour fabriquer directement des protéines. Entre les deux, la cellule utilise la séquence d’ADN du gène comme modèle pour fabriquer une « molécule messager » appelée « ARN messager » ou ARNm. La molécule messager ARNm est ensuite utilisée pour indiquer à la cellule quels éléments constitutifs assembler pour fabriquer la protéine.
Pour récapituler, l’ADN est utilisé comme modèle pour fabriquer un message ARNm, et la molécule messager est ensuite utilisée pour construire des molécules de protéine.
La maladie de Huntington est causée par un seul gène anormal, le gène qui indique aux cellules de produire la protéine appelée huntingtine. Chaque cellule possède deux copies de chaque gène. La plupart des personnes atteintes de la maladie de Huntington, ou celles qui la développeront plus tard, ont un gène « normal » et un autre avec trop de répétitions de la séquence à trois lettres « CAG » près du début. Cette simple « faute d’orthographe » entraîne une protéine « mutante » qui se comporte différemment de la protéine normale, endommageant les cellules et produisant les symptômes de la maladie de Huntington.
Vous avez peut-être entendu le terme « type sauvage » : c’est ainsi que les scientifiques appellent le gène et la protéine non mutants, ou « normaux ».
Silenciation du gène de la huntingtine
Étant donné que le gène anormal est la cause de tous les problèmes dans la maladie de Huntington, pourquoi ne pas simplement s’en débarrasser et le remplacer par un gène sain ? Malheureusement, il est peu probable que cela fonctionne, car les cellules ont des moyens très sûrs de protéger l’ADN pour éviter les dommages ou les altérations.
La molécule messager ARNm, en revanche, flotte dans la cellule, et tant qu’elle est là, elle continuera d’être utilisée pour fabriquer davantage de molécules de protéine. Si nous pouvions en quelque sorte dire à la cellule d’ignorer ce message, la protéine nocive ne serait pas fabriquée. C’est le raisonnement qui sous-tend la « silenciation génique ». L’idée est que les scientifiques pourraient créer un médicament qui est en fait une molécule messager spécialement conçue, qui se fixe au message de la huntingtine et dit à la cellule de s’en débarrasser.
La silenciation génique semble trop belle pour être vraie, mais elle ne l’est pas. En 1998, deux chercheurs, qui ont remporté le prix Nobel de médecine, ont découvert comment désactiver des gènes individuels. Ils ont appelé leur technique interférence ARN (ARNi).
La silenciation génique est désormais une technique standard utilisée par les scientifiques pour étudier le fonctionnement des organismes, la façon dont les maladies causent des dommages et comme moyen de développer des traitements. Un médicament de silenciation génique (Vitravene, utilisé pour traiter une infection oculaire virale) est autorisé pour l’usage humain, et plus d’une douzaine d’essais sont en cours dans de nombreuses maladies différentes, et d’autres sont en préparation.
Si c’était aussi simple que cela, nous aurions déjà des pilules de silenciation génique pour la maladie de Huntington, alors quel est le problème ? Eh bien, comme pour toute nouvelle technique, il y aura forcément des défis, des revers et des obstacles inattendus en cours de route.
Défi n° 1 : pénétrer dans le cerveau
L’un des principaux problèmes est d’amener les molécules de silenciation là où elles sont nécessaires. Dans la maladie de Huntington, la mort des cellules cérébrales appelées neurones est le principal problème, nous devons donc faire pénétrer la molécule dans ces cellules.
« Plusieurs groupes de chercheurs ont maintenant signalé des succès dans la réduction de la production de huntingtine dans des modèles animaux »
Le premier obstacle est de faire pénétrer le médicament dans le cerveau. Le cerveau possède un bouclier défensif naturel pour empêcher les substances nocives d’y pénétrer à partir du sang. C’est une bonne chose pour nous dans l’ensemble, car cela protège le cerveau, mais cela donne des maux de tête aux chercheurs de médicaments contre la maladie de Huntington, car il est beaucoup plus difficile de faire pénétrer des médicaments dans le cerveau que dans, par exemple, le foie ou les reins.
Il est donc peu probable qu’un simple comprimé ou une simple injection convienne pour lutter contre la maladie de Huntington avec la silenciation génique. Une façon de contourner ce problème est d’utiliser des pompes et de minuscules tubes pour perfuser le médicament de silenciation directement dans le cerveau ou dans le liquide qui l’entoure, le liquide céphalorachidien ou LCR. Cela semble assez intimidant, et il ne fait aucun doute que l’implantation de pompes ou de tubes dans le système nerveux est une affaire importante, mais en réalité, des systèmes similaires sont déjà utilisés pour administrer des médicaments dans d’autres maladies telles que la sclérose en plaques (SEP) et le cancer du cerveau, où ils ont un très bon bilan de sécurité.
Défi n° 2 : distribution
Une fois que le médicament est dans le système nerveux, le problème de la distribution n’est toujours pas résolu. Le cerveau est une boule de tissu dense dans laquelle il est difficile pour les molécules de silenciation de se propager. De plus, le traitement doit pénétrer à l’intérieur des cellules pour fonctionner : flotter entre les cellules ne suffit pas.
Les scientifiques utilisent différentes méthodes pour résoudre ce problème. Les lauréats du prix Nobel ont utilisé des molécules d’interférence ARN (ARNi) pour désactiver des gènes. Elles sont très similaires aux molécules produites naturellement par les cellules. L’inconvénient est qu’elles n’ont pas tendance à se propager naturellement dans le cerveau et qu’elles ne sont pas très douées pour pénétrer dans les cellules.
Ainsi, les chercheurs sur l’ARNi ont tendance à utiliser de très fins tubes, insérés dans la substance du cerveau, ciblant les régions les plus touchées, reliés à des pompes qui utilisent la pression pour propager davantage le médicament. Une autre option consiste à laisser les molécules d’ARNi « se faire transporter » à l’intérieur de virus désactivés, qui sont des experts dans la propagation dans le cerveau et l’injection de substances dans les cellules.
Une autre approche consiste à essayer différentes molécules qui pourraient être meilleures pour se propager et pénétrer dans les cellules. Les oligonucléotides antisens (ASO) sont similaires aux molécules d’ARNi, mais sont légèrement plus simples et ne sont pas produits naturellement par les cellules. Le principe est le même : ils se fixent à la molécule messager ARNm et empêchent la cellule de l’utiliser pour construire des protéines.
Les ASO semblent être bien meilleures pour se propager dans tout le cerveau et peuvent pénétrer dans les cellules assez facilement. Elles semblent également durer beaucoup plus longtemps, ce qui pourrait être une bonne ou une mauvaise chose, selon la façon dont elles font leur travail.
Quelle technique de silenciation génique est la meilleure ? Nous ne le savons tout simplement pas, c’est pourquoi l’ARNi et les ASO sont étudiés en même temps, pour voir laquelle est la meilleure.
Défi n° 3 : désactiver le gène
Le test clé d’un traitement de silenciation génique est de savoir s’il peut désactiver le gène avec succès. Jusqu’à présent, la recherche sur des modèles animaux de la maladie de Huntington a fortement suggéré que cela peut être réalisé, avec les traitements ARNi et ASO.
En 2005, une équipe de chercheurs dirigée par Bev Davidson dans l’Iowa a injecté des molécules d’ARNi dans le cerveau de souris atteintes de la maladie de Huntington et a obtenu une réduction de 85 % du message de la huntingtine. La fonction motrice et les anomalies cellulaires des souris se sont également améliorées. Depuis lors, plusieurs groupes de chercheurs ont signalé des succès dans la réduction de la production de huntingtine en utilisant diverses molécules différentes, y compris des médicaments ARNi et ASO. Les travaux les plus récents suggèrent que les avantages de perfusions même courtes sont maintenus pendant des périodes assez longues.
Défi n° 4 : choisir la bonne cible
Les chercheurs de médicaments aiment repérer les problèmes à l’avance plutôt que d’attendre qu’ils se produisent, et un problème possible avec la silenciation génique est ses effets sur la copie naturelle ou de type sauvage du gène de la huntingtine.
Nous savons que ne pas avoir du tout de huntingtine est dangereux. Les souris sans aucune copie du gène meurent avant leur naissance. La question clé est donc de savoir si la réduction de la huntingtine mutante qui est nécessaire pour traiter la maladie provoque une réduction de la huntingtine de type sauvage qui est dangereuse ?
Pour le moment, nous ne savons pas. Certains chercheurs estiment que seules de petites réductions de la huntingtine mutante suffiront à donner aux cellules la possibilité de se rétablir, nous n’avons donc pas à nous soucier des effets nocifs de la réduction de la protéine de type sauvage. D’autres pensent que nous devons développer des traitements qui ne désactiveront que la protéine mutante. C’est ce qu’on appelle la silenciation allèle-spécifique : un allèle est ce que nous appelons chacune des deux copies d’un gène.
La silenciation allèle-spécifique semble très judicieuse : si nous pouvons cibler le gène mutant, pourquoi ne le ferions-nous pas ? L’inconvénient est que pour cibler une seule copie d’un gène, vous devez rechercher dans l’ADN de chaque patient des différences d’« orthographe » individuelles entre les deux allèles. Heureusement, de telles différences sont courantes, mais nous aurions probablement encore besoin de plusieurs médicaments différents pour pouvoir fournir un traitement ciblé au plus grand nombre de patients possible. Certains patients n’ont pas de différences d’orthographe appropriées qui pourraient être ciblées de cette manière.
Le débat sur la nécessité ou non de la silenciation allèle-spécifique est en cours, mais la bonne nouvelle est que nous n’aurons pas à attendre plus longtemps pour obtenir une réponse, car les deux techniques sont testées en ce moment même par différents groupes de chercheurs.
Défi n° 5 : effets secondaires
Les traitements de silenciation génique pourraient encore avoir des effets secondaires, même si les problèmes possibles liés à la réduction de la huntingtine de type sauvage peuvent être évités.
Un problème est ce qu’on appelle les « effets hors cible », où la molécule du médicament se fixe à des molécules messager pour des gènes autres que la huntingtine et interfère avec celles-ci. Cela pourrait produire un certain nombre de problèmes.
Un autre problème est que le système immunitaire du cerveau pourrait finir par combattre les molécules « étrangères » qui y sont pompées, ce qui pourrait aggraver les choses.
Nous devons prendre ces effets secondaires possibles au sérieux maintenant, alors que nous en sommes encore au stade de les tester sur des animaux. Même des effets indésirables assez légers pourraient être de mauvaises nouvelles, surtout si la silenciation génique finit par être utilisée pendant de nombreuses années pour prévenir les symptômes chez les personnes qui ont subi un test positif.
Les scientifiques s’efforcent de produire les meilleures molécules avec le risque le plus faible d’effets secondaires graves, et seules les plus sûres seront proposées pour des essais sur l’homme.
Quand, quand, quand ?
L’enthousiasme suscité par la silenciation génique est justifié, car de nombreux chercheurs estiment que c’est notre meilleure chance de produire des traitements efficaces contre la maladie de Huntington. Il y a clairement beaucoup de problèmes à résoudre, mais chaque année qui passe, des progrès sont réalisés, et tout le monde s’accorde à dire que rien n’a été trouvé jusqu’à présent qui suggère que la technique ne fonctionnera pas chez les patients.
En ce moment, un essai de silenciation génique ASO est en cours chez des patients atteints de SLA (maladie du motoneurone). C’est vraiment important, car il teste non seulement le médicament, mais aussi le système d’administration par pompe et tube pour amener le médicament là où il est nécessaire. Pendant ce temps, de nombreux chercheurs à travers le monde cherchent à déterminer quelles molécules seront les meilleures à tester chez les patients atteints de la maladie de Huntington.
Nous ne pouvons pas dire avec certitude quand les traitements de silenciation génique seront disponibles pour les patients, mais HDBuzz serait déçu si nous ne voyions pas d’essais de silenciation génique humaine pour la maladie de Huntington dans un avenir très proche.
En savoir plus
- Article de synthèse récent sur la silenciation génique dans la maladie de Huntington par Dinah Sah et Neil Aronin dans le Journal of Clinical Investigation (accès libre)
- Le premier article décrivant l’amélioration chez une souris atteinte de la maladie de Huntington après un traitement de silenciation génique par ARN interférence (accès libre)
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…


