
Roche annonce les détails de son étude « cruciale » sur la réduction de la huntingtine
L’essai GENERATION-HD1 testera si le RG6042 – anciennement Ionis-HTTRx – ralentit la progression de la maladie de Huntington

C’est une période de grands développements dans le domaine des médicaments réduisant la huntingtine, qui visent à réduire la production de la protéine huntingtine causant la maladie de Huntington. Lors de la réunion du Réseau Européen de la Maladie de Huntington (EHDN) la semaine dernière, Roche a annoncé des détails précis sur la toute première étude
Qu’est-ce que la réduction de la huntingtine ?
Tout d’abord, un bref rappel sur la réduction de la huntingtine comme traitement de la maladie de Huntington. Rappelle-toi, les dommages au cerveau dans la MH sont causés par une protéine nocive, appelée huntingtine mutante. Le gène de la MH – parfois appelé le gène de la huntingtine – est une recette pour fabriquer la protéine huntingtine.

Quand une cellule a besoin de plus d’une protéine spécifique, disons la protéine huntingtine, elle fait une sorte de copie brouillon du gène – une molécule messagère qui est écrite en utilisant un produit chimique légèrement différent, appelé ARN. Parce que cet ARN transporte un message, les scientifiques l’appellent
C’est ainsi que fonctionnent les approches de réduction de la huntingtine pour traiter la MH – en ciblant l’ARN messager de la huntingtine et en disant aux cellules de l’ignorer ou de le supprimer. Moins de message, moins de protéine.
La plupart des chercheurs sur la MH trouvent cette approche très excitante, car le bon sens et une tonne de recherches sur les animaux suggèrent que si tu réduis ou élimines la protéine huntingtine mutante, tu diminues la gravité des symptômes de la MH.
Les ASO dans la maladie de Huntington
Un leader précoce dans le domaine de la réduction de la huntingtine est une entreprise de biotechnologie appelée Ionis Pharmaceuticals, de Carlsbad en Californie. Pendant des décennies, ils ont développé une approche appelée oligonucléotides antisens qui sont des molécules fortement modifiées ressemblant à l’ADN, programmées pour reconnaître un seul ARN messager spécifique flottant à l’intérieur d’une cellule.
Quand ces ASO se collent à leur cible programmée, les cellules le détruisent, réduisant considérablement les niveaux d’un ARN messager spécifique. Moins de messager signifie moins de protéine, même si le code génétique pour le gène de la Huntingtine est toujours présent dans l’ADN.
Sur la base du succès des tests sur les animaux, Ionis a mené une étude initiale sur 46 courageux volontaires atteints de la MH qui a commencé en 2015. Cette petite étude était conçue uniquement pour voir si son médicament réduisant la huntingtine, appelé HTTRx, était sûr, et si le traitement avec HTTRx réduisait la production de la protéine huntingtine dans le système nerveux. Nous ne pouvons pas prélever un échantillon de tissu cérébral, mais nous pouvons mesurer les niveaux de la protéine huntingtine mutante dans le liquide céphalo-rachidien qui baigne le cerveau.
Comme discuté sur HDBuzz, en décembre 2017, Ionis et leur partenaire Roche ont annoncé que l’essai avait été un succès. Remarquablement, aucun des 46 patients n’avait abandonné l’étude, malgré les injections mensuelles de liquide céphalo-rachidien requises. Et encore plus remarquablement, le traitement avec HTTRx a conduit à une réduction frappante des niveaux de la protéine Huntingtine dans le liquide céphalo-rachidien.
Roche est une énorme entreprise pharmaceutique basée en Suisse et sa branche américaine s’appelle Genentech. Parallèlement aux bonnes nouvelles du premier essai, Roche a confirmé qu’elle planifierait et dirigerait le prochain essai de HTTRx, qu’elle a renommé
Un essai pour tester l’efficacité
Bien sûr, les chercheurs et la communauté de la maladie de Huntington sont intéressés par le ralentissement de la progression de la MH, pas par le changement des niveaux de certaines mesures dans le liquide céphalo-rachidien. Mais l’étude de sécurité réussie d’Ionis n’avait que trois mois de dosage chez 46 patients – c’est trop court et trop petit pour dire si le traitement avait un effet sur les symptômes de la MH.
« GENERATION-HD1 sera lancé à la fin de 2018, avec les premiers patients recrutés au début de 2019. Il se déroulera sur environ 80-90 sites dans environ 15 pays. »
Maintenant que nous savons que le médicament d’Ionis/Roche réduit la protéine et semble être sûr, ce dont nous avons besoin maintenant est une grande étude dans un groupe beaucoup plus important de personnes – appelée un essai de phase 3 – pour déterminer si RG6042 ralentit la progression de la maladie de Huntington.
Depuis décembre, nous attendions avec impatience une annonce concernant cet essai plus important. Et le 16 septembre, nous l’avons eue !
GENERATION-HD1
Lors de la réunion 2018 du Réseau Européen de la Maladie de Huntington (EHDN), Scott Schobel de Roche a donné le premier aperçu officiel de l’étude à venir. L’essai sera connu sous le nom de GENERATION-HD1.
(Le nom GENERATION-HD1 vient de Global EvaluatioN of Efficacy and safety of Roche/genentech AnTIsense OligoNucleotide for Huntington’s Disease. Il vaut probablement mieux se souvenir simplement de l’acronyme…)
La taille est importante
GENERATION-HD1 sera lancé à la fin de 2018, avec les premiers patients recrutés au début de 2019. Il se déroulera sur environ 80-90 sites dans environ 15 pays.
Aucune annonce spécifique de site n’a été faite, ce qui signifie qu’il n’y a pas encore d’information publique sur la participation éventuelle d’une clinique ou même d’un pays donné à l’étude. Nous nous attendons à ce que cette information arrive bientôt.
Ce sera une très grande étude – recrutant 660 patients atteints de MH manifeste. ‘MH manifeste’ signifie simplement qu’ils recruteront des personnes formellement diagnostiquées avec des signes et symptômes cliniques de MH, pas des personnes avec la mutation mais sans symptômes définitifs (MH prémanifeste ou prodromale).
Éligibilité
Il y a deux principaux critères cliniques, ou critères d’inclusion. Premièrement, les patients doivent être « ambulatoires » et « verbaux » – c’est-à-dire capables de marcher et de parler. Deuxièmement, ils doivent obtenir 70% ou plus sur un test indépendant appelé l’Évaluation Fonctionnelle. Cela signifie un niveau de fonctionnement quotidien où ils peuvent se laver eux-mêmes et effectuer des tâches ménagères « limitées » comme cuisiner et utiliser un couteau.
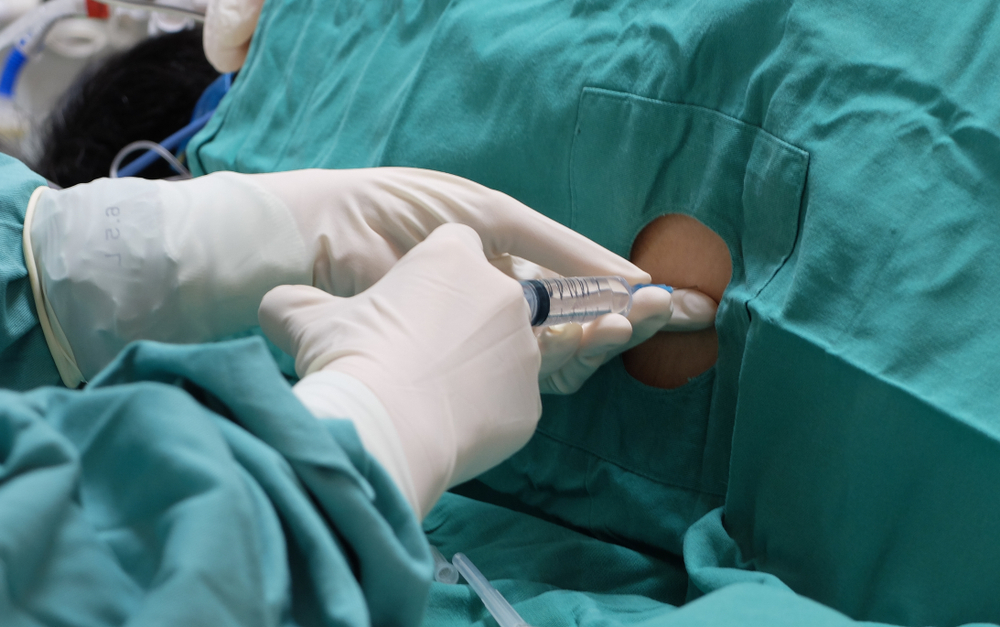
Ce sont des critères d’inclusion cliniques beaucoup plus larges que l’essai précédent, qui était très strictement limité à la MH très précoce avec un fonctionnement quotidien presque normal.
Il y a aussi une exigence spécifique qu’un score appelé score CAP doit être supérieur à une certaine valeur.
Le score CAP est une façon mathématique simple de combiner l’âge d’une personne et son nombre de répétitions CAG – la longueur du morceau anormal d’ADN qui cause la maladie de Huntington. Ce score est utilisé parce que les personnes avec des mutations MH plus sévères (répétitions CAG plus longues) ont tendance à avoir des symptômes de MH à un âge plus jeune. Donc si nous voulons suivre la progression des symptômes de MH au fil du temps chez une personne, nous devons prendre en compte à la fois son âge et la taille de son CAG. Fixer une exigence de score CAP minimum signifie que l’essai peut se concentrer sur les personnes les plus susceptibles de bénéficier du médicament, ce qui le rend aussi petit et rapide que possible.
Beaucoup de ponctions lombaires
L’essai inclura un groupe de traitement placebo ou factice, d’environ un tiers des participants à l’essai. Ce groupe est absolument nécessaire pour faire face à l’effet placebo – le fait que participer à un tel essai fait que les gens se sentent mieux, et fonctionnent même mieux, même si le médicament ne fonctionne pas.
Les deux autres tiers des participants seront divisés en deux groupes, recevant tous deux le médicament actif. La moitié du groupe traité recevra le médicament chaque mois, et l’autre moitié tous les deux mois. C’est excitant, car cela pourrait nous permettre de traiter moins fréquemment, si cela s’avère aussi efficace que le dosage mensuel.
Cependant, tous les participants de chaque groupe devront avoir des injections mensuelles dans le liquide céphalo-rachidien, chaque mois, pendant deux ans. Le groupe placebo recevra une injection de placebo chaque mois. Le groupe recevant le médicament mensuellement recevra le médicament chaque mois. Et le groupe bimensuel alternera entre les injections de médicament et de placebo. Cela signifie que personne ne saura dans quel groupe il a été assigné.
En résumé : tous les participants à l’essai devront être d’accord pour recevoir beaucoup de ponctions lombaires et d’injections spinales – jusqu’à vingt-cinq sur deux ans.
Mesures des résultats
Le succès ou l’échec de l’essai sera déterminé aux États-Unis par quelque chose appelé l’échelle de capacité fonctionnelle totale, ou TFC en abrégé. C’est une échelle d’évaluation très simple basée sur la capacité d’une personne à effectuer des tâches de base à la maison, à travailler et à prendre soin d’elle-même.
En Europe, l’essai utilisera une mesure légèrement plus sophistiquée, appelée échelle unifiée composite d’évaluation de la maladie de Huntington ou cUHDRS. Ce score prend en compte un éventail plus large de symptômes de la MH, combinant le TFC, un score de mouvement et certains tests de réflexion.
« Ce sera une très grande étude – qui recrutera 660 patients avec une MH manifeste. »
C’est un peu inhabituel, mais pas inédit, d’avoir un essai avec différents critères d’évaluation dans différents pays. Mais ces scores mesurent tous le même processus sous-jacent, qui est l’aggravation de la MH au fil du temps, et les différentes agences réglementaires semblent avoir des opinions différentes sur la meilleure façon de mesurer cela. Au final, nous nous attendrions à ce que les deux scores évoluent dans la même direction si le médicament fonctionne.
Tous les patients ne s’inscrivent pas le premier jour de l’essai, donc un essai dans lequel chaque participant est impliqué pendant 25 mois prendra environ deux fois plus de temps à réaliser, et possiblement plus longtemps.
Mais attendez, il y a plus
Roche a également annoncé une autre étude – appelée l’Étude d’Histoire Naturelle, visant à fournir des informations cruciales sur la progression de la MH. Jusqu’à 100 patients seront recrutés, appariés aux participants de l’étude d’Extension en Ouvert de RG6042 déjà en cours. Ces participants en ouvert sont les personnes du premier essai clinique, qui reçoivent maintenant toutes le médicament régulièrement, donc l’étude d’histoire naturelle aidera à comprendre les données émergentes de l’étude en ouvert. Si tout se passe comme prévu, les participants de l’Étude d’Histoire Naturelle se verront proposer un traitement en ouvert aussi, après 15 mois de participation incluant des ponctions lombaires régulières.
Et encore plus !
La réunion EHDN a inclus des mises à jour sur d’autres programmes passionnants de réduction de la huntingtine, incluant Wave Life Sciences, PTC Therapeutics et Uniqure. Nous fournirons bientôt des mises à jour sur ceux-ci et d’autres informations d’EHDN 2018.
Et maintenant ?
Faisant suite à la première étude qui a démontré la sécurité à court terme et la réduction réussie de la huntingtine, nous avons maintenant des détails solides sur une étude « pivot » pour prouver si RG6042 fonctionne ou non, et un calendrier très clair sur quand cela se produira.
Il est important de garder à l’esprit que les personnes qui participent à GENERATION-HD1 auront un chemin long et difficile devant elles, et participer sera un travail difficile, physiquement et mentalement.
Inévitablement, il y aura aussi beaucoup de personnes qui ne pourront pas participer pour une raison ou une autre. Bien que cela puisse être énormément décevant pour ces personnes, le médicament sera testé par des volontaires à travers le monde, et il est important d’essayer de se rappeler que le but de l’essai est de tester le médicament pour tout le monde et pour les générations futures – pas de donner le médicament à une personne en particulier.
Cela dit, c’est une nouvelle énorme. Après de nombreuses années de travail par des centaines de personnes, nous avons enfin un calendrier pour comprendre si le traitement avec ce médicament réducteur de huntingtine, RG6042, pourrait bénéficier aux symptômes de la MH.
Nous sommes vraiment enthousiastes à propos de cette annonce, et de l’état du domaine de la réduction de la huntingtine plus généralement. Nous pensons qu’il est juste pour les membres de la communauté MH de ressentir la même chose. Restez à l’écoute d’HDBuzz, pour des mises à jour sur ceci et d’autres développements d’essais.
En savoir plus
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…


