Conférence thérapeutique sur la maladie de Huntington 2019 – jour 3
Nouveaux éclairages sur la protéine huntingtine et progrès accomplis dans la transformation des spécificités génétiques qui modifient l'évolution de la MH en traitements, le dernier jour de la conférence thérapeutique.

Jeff et Ed rendent compte de la conférence thérapeutique portant sur la maladie de Huntington – le plus grand rassemblement annuel de chercheurs MH. La conférence de cette année est plus importante et plus passionnante que jamais.
Sur le premier jour ici.
Sur le second jour ici.

Jeudi matin – Structure et fonctions de la huntingtine
La dernière journée de la conférence thérapeutique MH débute par une session portant sur la biologie du gène MH lui-même. Il est important de comprendre ce que fait normalement ce gène, et de quelle manière ces fonctions sont altérées par la mutation responsable de la maladie de Huntington. Le gène MH, appelé « Huntingtin » par les scientifiques, n’est pas seulement présent chez les patients MH mais chez tous les êtres humains de la planète. Pourquoi avons-nous ce gène et que fait-il pour aider nos cellules à survivre ?
Premier intervenant : Rick Myers, de Hudson Alpha, décrit les travaux de son laboratoire qui tente de comprendre ce qui active le gène. Les gènes résident dans notre ADN où ils sont silencieux jusqu’à ce qu’ils soient appelés par la machinerie cellulaire, laquelle se met alors au travail pour activer des gènes spécifiques. Les travaux de Myers pourraient nous aider à comprendre la biologie fondamentale du gène MH, ce qui est important, mais pourraient également fournir de nouveaux outils pour réduire son expression. Le gène MH n’est pas seulement présent dans les cellules cérébrales mais dans beaucoup (ou peut-être toutes) de cellules du corps.
Myers fait partie d’un vaste consortium de chercheurs, appelé ENCODE projet, qui tente de comprendre comment les modifications apportées à la structure de l’ADN permettent d’activer ou de désactiver certains gènes. Pour en savoir sur le projet ENCODE Wikipedia page.
L’ADN est chimiquement modifié dans les cellules afin de le rendre plus adhérent ou plus souple et plus ouvert. Il s’enroule également sur lui-même – Myers décrit des boucles d’ADN interagissant sur de très longues distances. L’équipe de Myers a identifié des séquences d’ADN, plus de 100 000 lettres ADN à l’extérieur du gène MH lui-même qui contrôlent son expression. Ils établissent essentiellement une carte du voisinage ADN du gène MH – ce qui l’active et ce qui le désactive ? Ces énormes boucles autour du gène MH interagissent de manière spécifique. Dans la mesure où elles sont si reproductibles, ceci signifie probablement que ces boucles jouent un rôle important dans l’activation et la désactivation du gène MH.
Prochain intervenant : le Professeur Gill Bates de UCL décrit les travaux de son laboratoire sur la compréhension du processus « d’épissage » du gène MH. La plupart des gènes – surtout les plus gros, tels que le gène MH – sont consignés dans des fragments d’ADN, entrecoupés de longs segments d’ADN qui ne contribuent pas du tout à la protéine. La majeure partie de l’ADN située dans la région du « gène HD » ne fait donc pas réellement partie du gène. La biologie est bizarre ! Ainsi, lorsque les cellules ont besoin d’un gène, comme le gène MH, elles doivent lire chaque bloc – comme les chapitres d’un livre – et retirer tout l’ADN sans importance entre eux. Il existe 67 de ces chapitres dans le gène MH. Ce processus d’assemblage de tous les chapitres s’appelle « l’épissage ».
Le laboratoire de Bates a découvert quelque chose de très étrange – dans les gènes MH mutants, il reste parfois un peu d’ADN entre le chapitre 1 et le chapitre 2 lorsque le gène est épissé. Ceci ne devrait pas arriver – chaque chapitre est normalement bien coupé et collé à ses voisins. Ce qui conduit à la génération d’une minuscule protéine MH – en réalité seulement environ 3% de la protéine MH totale. Le laboratoire de Bates tente actuellement de déterminer si cette minuscule protéine MH pourrait engendrer des problèmes au cerveau des personnes porteuses de la mutation MH.
Ils examinent actuellement des échantillons de cerveaux, légués par des patients MH, où ils constatent un épissage altéré du gène MH, ce qui correspond à ce qu’ils ont observé chez les souris. Mais, ces changements sont-ils importants ? Le laboratoire de Bates travaille avec deux lignées de souris MH, dont la gravité de la maladie est différente, afin de comprendre cela. Les souris présentant ce changement d’épissage sont davantage malades, ce qui est conforme avec leur hypothèse. Ce laboratoire adopte actuellement une approche encore plus directe, en créant des souris dépourvues du morceau d’ADN supplémentaire collé accidentellement dans les gènes MH mutants. Ces souris devraient nous permettre de déterminer si ces modifications de l’épissage ont un impact sur la MH. La plupart des mini-protéines MH étranges manquent à ces souris, mais celles-ci sont par ailleurs normales. Elles devraient donc nous permettre de comprendre l’importance de la minuscule protéine MH. Reste à savoir ce que cela signifie pour les patients atteints de la MH humaine !
Ensuite, Chris Ross de l’Université Johns Hopkins aborde le sujet de la « modification post-traductionnelle » – c’est-à-dire des petites modifications chimiques apportées aux protéines qui modifient leur comportement. Comme si peindre des bandes sur une voiture la rendrait plus rapide. Notre meilleur frère-ennemi, la protéine huntingtine, peut être modifié de nombreuses façons après avoir été produit. Nous savons où se situent ces modifications, sur toute la longueur de la protéine, mais leur rôle, leur ajout ou leur suppression, leur possibilité de rendre la protéine plus ou moins nocive sont moins clairs.

L’équipe de Ross a examiné des dizaines de modifications individuelles et les a testées dans des cellules cultivées sur boîte de Pétri. Elle a étudié si ces modifications rendaient la protéine plus ou moins susceptible de tuer les cellules, et a constaté que certaines modifications réduisaient les effets nocifs de la protéine huntingtine. Certaines de ces modifications, ainsi que les machines qui les ajoutent ou les suppriment, pourraient constituer de bonnes cibles pour des traitements destinés à protéger les neurones.
L’année dernière, il y a eu une grande percée ; la structure de la protéine a été comprise pour la première fois – Pour en savoir plus à ce sujet ici. Ceci permet aux personnes astucieuses, comme Ross, de comprendre pour la première fois où les modifications étudiées se situent exactement sur la protéine dans l’espace 3D. Mais comment transformer ces modifications en traitements ? La première étape consiste à déterminer quel changement nous voulons produire (pour rendre la protéine moins dangereuse). La prochaine étape est de déterminer quelle machine à enzymes applique ou non les modifications les plus intéressantes.
Un petit « ooh » a émané du public lors de ce beau travail pour réunir deux grands domaines de recherche sur la MH : la structure de la huntingtine et la modification post-traductionnelle.
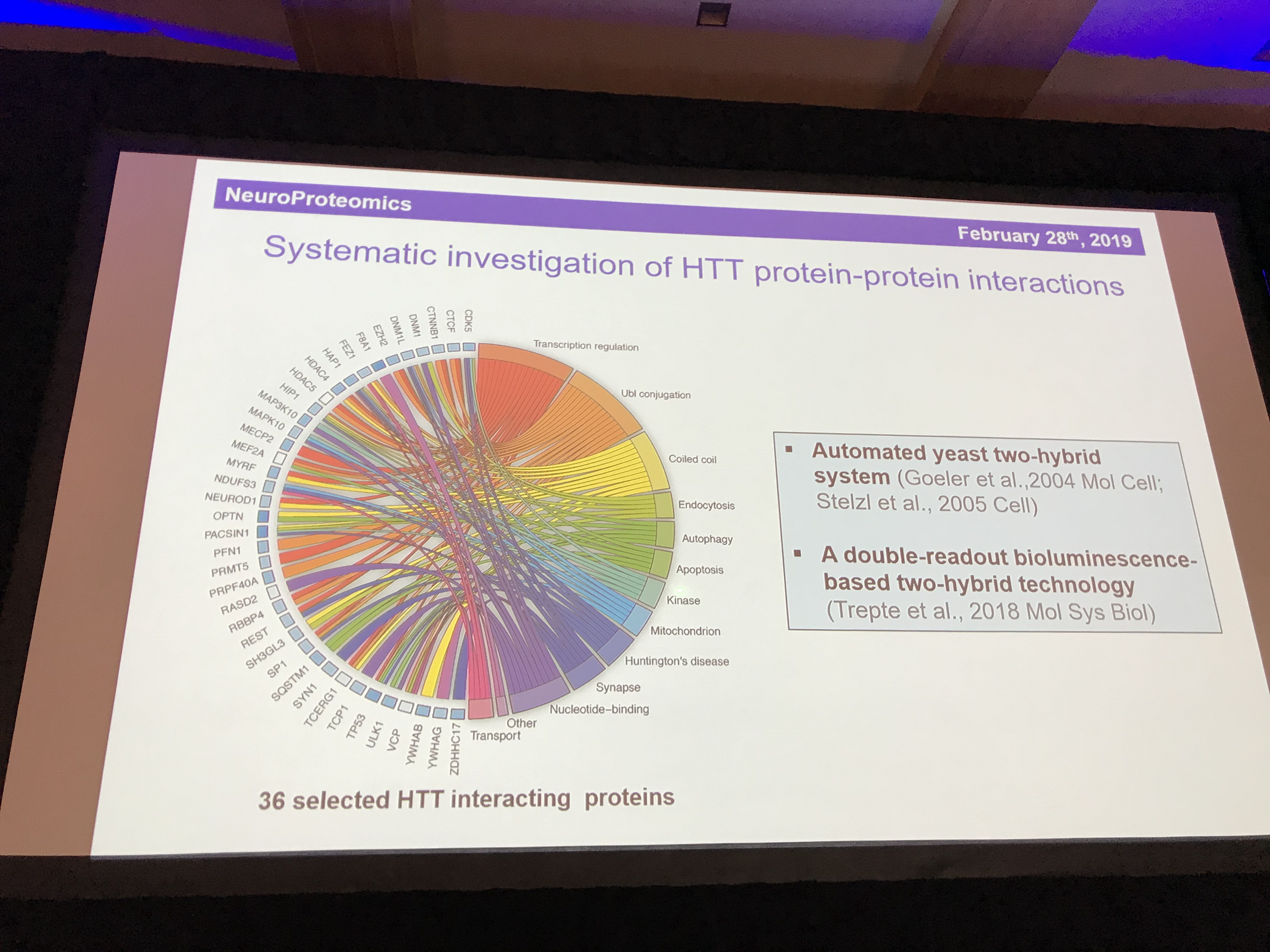
Le dernier intervenant de cette session est Erich Wanker (avant que vous ne le demandiez, il est autrichien, donc le W est prononcé comme un V)(et là tu ne peux pas le traduire car en anglais « wanker » signifie « connard ». Mais ça le fait pas en Français). Erich est un important expert en matière de comportements de la protéine huntingtine. Il utilise des mouches à fruits pour étudier la façon dont la protéine MH mutante provoque la mort cellulaire. Comme Chris Ross, les travaux d’Erich ont été considérablement renforcés par la découverte, l’année dernière, de la structure de la protéine huntingtine. L’une des choses les plus importantes à propos d’une protéine est ses amis – quelles autres protéines fréquente-t-elle ? Nous appelons cela les « partenaires d’interaction » d’une protéine. Après avoir réduit la liste des 413 partenaires d’interaction à 36 qui paraissent particulièrement intéressants ou importants, il cherche à savoir lesquelles de ces interactions trouvées dans la littérature scientifiques sont réelles et comment la huntingtine se lie fortement à chacune d’elles. Pour rendre cela plus réaliste, il étudie les interactions à l’intérieur des cellules vivantes. Son système de test examine la puissance et la proximité des interactions afin de nous permettre de déterminer quels partenariats sont les plus importants pour la huntingtine. Les partenariats indiquent les rôles importants de la huntingtine dans le recyclage, le transport et le conditionnement des molécules de signalisation dans des petites bulles appelées vésicules. Une protéine, HAP1, semble particulièrement importante. HAP est synonyme de protéine associée à la huntingtine ; donc elle porte bien son nom. HAP40 est un autre partenaire important mais on ne sait pas encore pourquoi. La cartographie des effets de ces partenaires nous aidera à comprendre la huntingtine sous ses formes mutante et saine.
- Jeudi après-midi – Réparation et manipulation de l’ADN
La conférence se termine sur une session très intéressante portant sur les modificateurs génétiques – des gènes, autres que le gène MH qui, à notre avis, sont importants pour la MH. Il a été démontré que des variations dans ces gènes provoquent plus précocement ou plus tardivement les symptômes MH. Nous avons déjà parlé de cette idée sur HDBuzz – pour en savoir plus.
La première oratrice de cet après-midi est Marcy MacDonald, du Massachusetts General, un membre clé de l’équipe qui a identifié le gène MH en 1993. Depuis lors, elle poursuit ses travaux sur la compréhension de la génétique de la maladie de Huntington.
MacDonald a abordé les travaux d’un groupe de chercheurs appelé le consortium « GeM-HD ». Ils étudient les variations ADN à l’extérieur du gène MH, lesquelles sont associées avec l’apparition précoce ou tardive des symptômes MH. Elle indique : « La nature a déjà mené à bien un essai MH », ce qui signifie que depuis, nous avons constaté des personnes ayant hérité de petites excentricités dans leur ADN entraînant l’apparition subséquente des symptômes MH à un stade plus avancé. Il s’agit vraiment d’une bonne nouvelle dans la mesure où nous n’avons pas à nous demander s’il est possible de ralentir l’évolution de la MH – ces personnes prouvent que cela est possible. Nous devons maintenant trouver comment recréer ces effets génétiques avec des médicaments que nous pourrions donner à tout le monde.
Ces études sur les modificateurs génétiques commencent avec une vaste collection de patients MH dont nous connaissons l’âge d’apparition des signes moteurs de la MH. Bien que celui-ci soit en grande partie défini par la « taille de CAG » qu’une personne hérite de son parent atteint de la MH, il existe encore beaucoup de variations lorsque les symptômes débutent. Les chercheurs utilisent des puces électroniques spéciales pour lire un grand nombre de lettres ADN – 11 000 000 d’entre elles. Il en résulte une sorte de carte de haut niveau de la collection complète d’ADN, ou « génome », de chaque participant.
Après avoir réalisé cette opération chez 4 000 patients MH, le consortium GeM-HD a découvert quatre zones différentes du génome que nous avons constaté chez des personnes ayant été atteintes de la MH précocement ou tardivement. En réalité, ils ont trouvé des variations liées à l’accélération ou au retardement de la MH. On peut donc prédire que les personnes qui héritent de l’une de ces variations présenteront des symptômes de la MH plus tôt ou plus tard que les autres. Ceci est non seulement important pour eux mais utile pour tout le monde, car l’identité de ces gènes peut nous apprendre beaucoup de choses sur la MH. Il est très intéressant de noter que plusieurs de ces gènes sont importants pour aider les cellules à réaliser un processus appelé la réparation de l’ADN. Ce qui suggère que des incidents techniques dans la réparation de l’ADN pourraient entraîner le développement de la MH.
MacDonald décrit maintenant les résultats de leur nouvelle étude comprenant plus de 9 000 sujets ! Celle-ci révèle plusieurs autres gènes qui influencent l’âge d’apparition de la MH, notamment plus de gènes de réparation de l’ADN. Il est intéressant de noter que de rares variations dans le gène MH lui-même ont également modifié l’âge d’apparition de la MH. Nous ne le disons pas souvent mais la raison en est trop compliquée pour être présentée. Nous allons donc publier un article sur HDBuzz la semaine prochaine.
L’équipe de MacDonald développe également de nouvelles techniques mathématiques pour mieux appréhender l’évolution de la MH, dont elle sait qu’elle est plus compliquée qu’un simple « diagnostic ». Plus précisément, ils ont essayé d’estimer avec précision à quel point les tâches quotidiennes des personnes sont perturbées dans le cadre de la MH plutôt que de ne définir qu’un seul point « d’apparition » ou de « diagnostic ». Ils ré-analysent toutes les études sur les modificateurs génétiques à l’aide de ces nouveaux outils pour voir s’ils peuvent savoir quels gènes sont importants pour les différents aspects des symptômes de la MH.
L’intervenant suivant est Peter Holmans, de l’Université de Cardiff, qui est également un membre du consortium GeM-HD et s’intéresse de près à la façon dont les changements génétiques contribuent à la maladie. Il s’adresse à l’auditoire présentant un type de score génétique appelé « score de risque polygénique ». Cela semble compliqué mais le concept est assez simple : il s’agit d’une façon de combiner de très petits risques génétiques en un seul score de risque combiné. Contrairement à la MH, de nombreuses maladies ne sont pas causées par une seule mutation dans un seul gène mais sont influencées par de nombreux petits risques génétiques. Maintenant que nous pouvons mesurer à moindre coût et facilement des centaines ou des milliers de variations génétiques, nous pouvons calculer facilement les scores de risque polygénique.
Holmans se concentre sur les symptômes psychiatriques de la MH, tels que l’agression, la dépression et les comportements problématiques. Il adopte une approche intéressante consistant à rechercher des variations génétiques qui influencent ces symptômes indépendamment de l’évolution générale de la MH. En utilisant des scores de risque polygéniques de maladies psychiatriques telles que la dépression majeure, Holmans observe que les patients MH présentant ces variations génétiques sont davantage susceptibles de présenter des symptômes spécifiques. Après davantage de travaux, cela pourrait permettre aux familles MH d’avoir une idée des symptômes qu’elles risquent de développer tout particulièrement. Dans la mesure où bon nombre de ces symptômes, y compris la dépression, peuvent être traités, il serait utile que les familles en aient connaissance.
Intervenant suivant, Hilary Wilkinson, de la fondation CHDI, décrit les efforts de la fondation pour comprendre comment les gènes de réparation de l’ADN pourraient jouer un rôle dans le développement de la MH. En plus du gène MH proprement dit, ces nouvelles pistes génétiques constituent désormais les moyens les plus intéressants pour influer sur la maladie. En effet, les études sur les modificateurs génétiques réalisées chez des patients atteints de MH suggèrent que des modifications minimes de la séquence de ces gènes peuvent influer de manière significative sur l’âge d’apparition de la MH. L’intérêt de réaliser des tests génétiques est d’identifier les gènes que nous pouvons essayer de manipuler à l’aide de produits chimiques dans l’espoir de reproduire les effets génétiques.
CHDI finance et soutient un large éventail d’efforts pour comprendre exactement quels gènes de réparation de l’ADN influent sur le gène MH, et si nous pouvons développer des médicaments pour essayer de le faire chez les patients MH. En utilisant des modèles murins, les chercheurs MH peuvent effectuer des modifications génétiques précises qui désactivent les gènes de réparation de l’ADN afin d’étudier leur impact sur le gène MH et les symptômes de type MH chez les souris. Wilkinson décrit un phénomène appelé « instabilité somatique », lequel se traduit par un allongement des répétitions CAG du gène MH. Cela se produit dans certaines cellules du corps, mais pas dans toutes, y compris les cellules cérébrales les plus vulnérables qui meurent dans le cadre de la MH. La plupart des gènes découverts dans des études portant sur l’ensemble du génome jouent un rôle dans le processus d’instabilité somatique, ce qui a suscité un vif intérêt pour le processus dans le domaine de la MH.
Wilkinson a conclu en décrivant un très large éventail d’expériences menées directement par la fondation CHDI en collaboration avec des partenaires académiques afin de rechercher des médicaments susceptibles d’influencer le processus d’instabilité somatique.
C’est tout pour la conférence thérapeutique MH de cette année! Veillez à lire le jour 1 ici et le jour 2 ici et suivez la conversation sur Twitter.
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…