Annonce d’un essai clinique sur la maladie de Huntington : un médicament réduisant la huntingtine entrera en essai de phase I en 2015
Un essai clinique pour une thérapie prometteuse contre la MH est prévu pour 2015. La première étape est de s’assurer qu’elle est sûre.

Un nouvel essai clinique vient d’être annoncé pour 2015 visant à tester une thérapie de « réduction de la huntingtine », appelée oligonucléotide antisens (ASO), qui s’attaque directement à la huntingtine mutante. Nous sommes extrêmement enthousiastes – c’est le tout premier essai humain sur la MH qui s’attaque à la racine du problème, et il a montré de grands espoirs dans les modèles animaux. Quelles sont les dernières nouvelles ?
Un médicament potentiel ciblant le gène de la MH
L’essai clinique annoncé représente une collaboration entre Isis Pharmaceuticals, basée en Californie, et le géant pharmaceutique suisse Roche. Le médicament, appelé ASO-HTT-Rx, est une thérapie qui vise à traiter la MH en ciblant le gène lui-même.
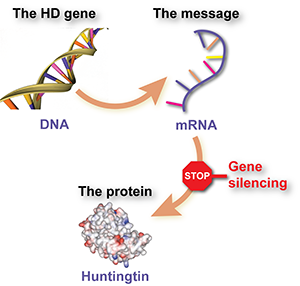
Le cœur du problème dans la MH réside dans une séquence d’ADN défectueuse – une séquence trop longue de blocs CAG dans le gène de la huntingtine. Les instructions contenues dans le gène mutant sont d’abord copiées dans une copie intermédiaire ‘messagère’, à partir de laquelle la protéine nocive est fabriquée. Ainsi, le gène mutant est la racine du problème, mais il n’est mauvais que parce que les cellules utilisent l’information du gène pour fabriquer une protéine nocive.
La stratégie derrière ASO-HTT-Rx est de « tuer le messager », en s’attaquant à l’étape intermédiaire entre le gène et la protéine en provoquant la destruction de la copie messagère.
Ces types de médicaments sont appelés ‘oligonucléotides antisens’, ou ASO. Ce sont des molécules synthétiques ressemblant à l’ADN qui peuvent entrer dans les cellules, se fixer au message ARN de la huntingtine mutante et provoquer sa dégradation. S’il fonctionne comme prévu, ce traitement empêchera la fabrication de la protéine huntingtine – une stratégie de « réduction de la huntingtine » qui, à long terme, a le potentiel de ralentir ou d’arrêter la progression de la maladie.
Chaque ASO a une structure de base qui peut être ajustée pour l’aider à se fixer au bon message cible, ignorant les milliers d’autres messages dans la cellule. C’est un peu comme quand tu vas à la quincaillerie pour faire copier une clé – le vendeur sélectionne la clé vierge correspondante puis grave la bonne séquence de rainures pour s’adapter à ta serrure, mais à aucune des serrures de tes voisins. Dans le cas des ASO, les scientifiques d’Isis utilisent l’une de leurs molécules ‘squelettes’ établies et la personnalisent, faisant en sorte que le médicament n’attaque que le message de la Huntingtine.
Tout cela semble être une technologie de pointe, mais la bonne nouvelle est qu’Isis a déjà testé des médicaments à base d’ASO dans des cerveaux humains, dans des traitements expérimentaux pour la SLA (maladie de Lou Gehrig, ou maladie du motoneurone) et l’ASM (atrophie musculaire spinale), et il n’y a eu aucun problème de sécurité signalé.
Administration du médicament
Une différence majeure entre les ASO et les traitements médicamenteux conventionnels est qu’ils ne peuvent pas être pris par voie orale sous forme de pilule, mais doivent être administrés directement au système nerveux.
Pour atteindre le cerveau, ASO-HTT-Rx sera administré via une aiguille insérée dans l’espace rempli de liquide sous la moelle épinière inférieure. Si cela semble extrême, sois rassuré que cette méthode est couramment utilisée dans de nombreux domaines de la médecine. Une stratégie similaire est utilisée par les oncologues pour administrer des médicaments de chimiothérapie aux patients atteints de tumeurs cérébrales. Plus couramment encore, de nombreuses femmes reçoivent une administration similaire ‘péridurale’ de médicaments contre la douleur pendant l’accouchement.
Un avantage majeur des médicaments comme ASO-HTT-Rx est que les chercheurs pensent qu’ils peuvent être administrés de manière intermittente tout en restant efficaces. Les scientifiques ont surnommé cette approche de traitement intermittent dans la MH une ‘pause de huntingtine’ ; visant à donner au cerveau une pause réparatrice des dommages causés par la protéine Huntingtine mutante.
Une fois injecté dans le liquide céphalo-rachidien, il faut environ 4 à 6 semaines pour que ASO-HTT-Rx fasse effet, et d’après les études sur les animaux, nous pensons que le silençage durera ensuite environ 4 mois. Pour le moment, l’étude est conçue pour que les patients reçoivent le traitement médicamenteux une fois par mois.
« Des médicaments similaires à ASO-Htt-Rx ont restauré en toute sécurité des comportements sains dans des modèles animaux de MH, et le passage du traitement aux humains est une étape excitante pour toute la communauté MH. Aussi excitante que soit cette science, le premier essai prévu est strictement conçu pour comprendre si le médicament est sûr. »
La sécurité d’abord
La décision d’aller de l’avant avec un essai clinique commençant en 2015 est le résultat de plus de dix ans de travail impliquant de nombreux chercheurs tant dans le milieu universitaire que dans l’industrie. Lorsqu’ils sont traités avec ASO-Htt-Rx, les souris de laboratoire qui modélisent la MH montrent des bénéfices robustes – même les traiter avec des ASO après qu’elles montrent des symptômes conduit à des améliorations dans leur cerveau et leur comportement.
Les chercheurs d’Isis et le Prof Sarah Tabrizi, de l’University College London et responsable mondiale de l’étude ASO-HTT-Rx, soulignent que ce premier essai clinique est conçu uniquement pour évaluer sa sécurité.
C’est un point crucial. Aussi excitante que soit cette science, le premier essai prévu est strictement conçu pour comprendre si le médicament est sûr. L’injection directe de tout médicament dans le système nerveux ne peut pas être faite à la légère – tous les risques potentiels et les effets secondaires doivent être examinés de manière exhaustive chez un petit nombre de patients volontaires.
Anatomie d’un essai clinique
Tous les essais cliniques de Phase I visent avant tout à évaluer la sécurité et la tolérance des nouveaux médicaments. Cela signifie qu’un petit groupe de patients (probablement environ 36) sera traité avec différentes quantités d’ASO-Htt-Rx, afin de déterminer si le médicament a des effets secondaires indésirables, et pour aider à trouver la dose optimale.
Environ 25% des patients impliqués recevront une injection placebo (qui ne contient aucun médicament) pour servir de groupe de comparaison. Les médecins surveilleront les symptômes des patients en réponse au traitement, mais l’objectif principal de cet essai est de savoir si le nouveau médicament est sûr.
Une fois qu’un médicament a été jugé sûr en Phase I, il peut passer à la Phase II. C’est à cette deuxième étape que les médecins peuvent recruter un plus grand nombre de patients et commencer à examiner l’efficacité du médicament dans le traitement des symptômes de la maladie. Ayant établi la sécurité et la dose dans le premier essai, les chercheurs peuvent maintenant poser la question : ‘Est-ce que ce traitement améliore (ou aggrave !) les symptômes de la MH des gens ?’
Si les résultats de l’essai de Phase II sont positifs, un essai de Phase III implique un nombre encore plus grand de patients, examinant soigneusement les effets secondaires, l’efficacité et la sécurité du médicament. Un essai de Phase III réussi est le type de résultat dont les entreprises pharmaceutiques ont besoin pour faire approuver un médicament par les agences réglementaires nationales.
Crédit image : Shutterstock
Qu’est-ce que cela signifie pour les patients atteints de MH ?
Le processus complet de mise sur le marché d’un médicament prend des années, même si tout se passe parfaitement. Si ASO-Htt-Rx s’avère sûr dans l’étude de Phase I qui vient d’être annoncée, ce premier résultat n’est que le début d’un long chemin en clinique. Chaque essai le long de ce chemin, Phases I, II et III, impliquera un nombre relativement faible de patients traités. De plus, au sein de chacun de ces essais, certains des volontaires recevront un traitement placebo pour servir de comparaison aux patients recevant HTT-ASO-Rx.
Les patients de l’essai de Phase I de HTT-ASO-Rx seront recrutés dans seulement quelques centres médicaux en Europe et au Canada. Un petit ensemble de centres de recherche sur la MH désignés, qui seront annoncés au début de 2015, cherchera à recruter des participants à l’essai. Les recrues seront des personnes aux premiers stades de la MH, mais les critères d’inscription spécifiques, les lieux et le calendrier ne sont pas encore des informations publiques. Nous savons avec certitude qu’une planification détaillée se déroule en coulisses, et que tout le monde travaille très dur pour faire avancer cet essai le plus rapidement possible.
Sécurité, incertitude, espoir
En résumé, nous sommes enthousiastes à l’idée que le premier essai humain d’un médicament ciblant la cause profonde de la MH commencera dès l’année prochaine. Cet enthousiasme est tempéré par la réalisation que ce premier essai concerne uniquement la sécurité, n’implique qu’un très petit nombre de patients atteints de MH, et que de nombreux détails de l’étude sont encore incertains.
Des médicaments similaires à ASO-Htt-Rx ont restauré en toute sécurité des comportements sains dans des modèles animaux de MH, et le passage du traitement aux humains est une étape excitante pour toute la communauté MH. Nous suivrons les progrès de l’essai avec un œil attentif, afin de pouvoir, espérons-le, fournir des doses intermittentes d’optimisme prudent.
En savoir plus
- Lien vers le site web d’Isis Pharmaceuticals, développeur de la thérapie ASO-HTT-Rx
- HDBuzz interviewe le Prof Sarah Tabrizi, responsable mondiale de l’essai thérapeutique ASO-HTT-Rx
- Présentation scientifique du Prof Sarah Tabrizi lors de la réunion 2014 du réseau européen de la maladie de Huntington annonçant le lancement de l’essai ASO-HTT-Rx
Sources et références
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…