Conférence thérapeutique sur la maladie de Huntington - Jour 1
Compte-rendu de HDBuzz sur la conférence thérapeutique MH annuelle à Palm Springs

 Par Dr Rachel Harding, Dr Sarah Hernandez et Joel Stanton 20 avril 2020 Edité par Professor Ed Wild Traduit par Michelle Delabye & Dominique Czaplinski Initialement publié le 27 février 2020
Par Dr Rachel Harding, Dr Sarah Hernandez et Joel Stanton 20 avril 2020 Edité par Professor Ed Wild Traduit par Michelle Delabye & Dominique Czaplinski Initialement publié le 27 février 2020
Nos nouvelles rédactrices Rachel Harding et Sarah Hernandez font un compte-rendu sur la conférence thérapeutique concernant la maladie de Hungtington - le plus grand rassemblement annuel de chercheurs MH.
Mardi matin - Génotype et phénotype de la maladie de Huntington
Bonjour de Palm Springs ensoleillé ! Nous sommes ravis d'être ici pour la 15e conférence thérapeutique MH annuelle. Cette année, en plus d'Ed et Jeff, nous sommes rejoints par de nouveaux rédacteurs de HD Buzz - Dr. Rachel Harding et Dr. Sarah Hernandez. Joel Stanton compile la conférence sur Twitter en direct dans nos publications quotidiennes.

La première session s’intitule “Génotype et Phénotype”, les discussions ont porté sur la façon dont la mutation MH (génotype) modifie les symptômes de la MH (phénotype). Premier intervenant, le Dr Seth Ament qui décrit les travaux de son laboratoire pour essayer de cartographier les premiers changements qui apparaissent dans les cellules cérébrales des souris porteuses de la mutation MH. Les cellules de notre corps, en ce compris celles du cerveau, possèdent un ADN qui code plus de 20 000 gènes. L’activation ou l’inactivation de ces gènes dans une cellule donnée détermine le fonctionnement de celle-ci. Le laboratoire d’Ament a étudié ce changement dans l’expression des gènes et s’efforce de comprendre les facteurs spécifiques qui amènent les cellules à exprimer différents ensembles de gènes, dans l’espoir que cela puisse être réparé.
Le Dr Ament décrit tout d’abord ses travaux de cartographie s'agissant des endroits où la protéine huntingtine, l’origine du gène MH, adhère à l’ADN. La façon la plus évidente selon laquelle la huntingtine pourrait modifier les gènes activés ou désactivés est de s'adhérer directement à l'ADN. En fait, la protéine huntingtine adhère à différentes parties du génome chez les souris MH par rapport aux souris ordinaires, ce qui suggère que la huntingtine pourrait faire quelque chose directement à l’ADN, lequel est important pour comprendre la MH.
Chez les souris MH, la huntingtine adhère à l’ADN à des endroits où il existe beaucoup d’actions, gènes lus et utilisés, ce qui suggère que la huntingtine mutante pourrait faire quelque chose d’unique dans les zones où les gènes sont activement utilisés. Ce changement dans la huntingtine adhérant à l'ADN dans différentes zones pourrait-il expliquer comment les cellules contenant la huntingtine mutante, obtiennent des jeux de cellules légèrement modifiés.
En fait, les zones sur lesquelles adhère la huntingtine chez les souris mutantes contiennent les gènes mêmes qui sont modifiés dans les cellules MH, ce qui suggère que cela pourrait être vrai. L’équipe du Dr Ament a trouvé une relation surprenante : ils peuvent prédire à quel point une zone donnée de l'ADN est active ou inactive en fonction de l'adhérence de la protéine huntingtine.
Le Dr Ament décrit ensuite les efforts de son laboratoire pour cartographier les gènes qui sont modifiés dans le cerveau MH. De nouvelles technologies étonnantes permettent aux chercheurs de cartographier les gènes dans des cellules individuelles. Le laboratoire du Dr Ament travaille avec ces techniques dans le cadre de ‘l’initiative NIH’sBRAIN’. Celui-ci a utilisé ces nouvelles techniques pour examiner les changements dans plus de 13 000 cellules cérébrales individuelles de la souris MH. Il existe un certain nombre de types différents de cellules cérébrales et l’approche du Dr Ament lui permet de cartographier séparément les changements dans chacun de ces types de cellules. Cela donne une image beaucoup plus claire que de les assembler et d’analyser l’ensemble. Ces résultats ouvrent la voie à une compréhension beaucoup plus affinée de ce qui se passe exactement dans chaque type de cellule - ce qui pourrait aider les chercheurs à comprendre comment traiter chaque type de cellule individuellement.
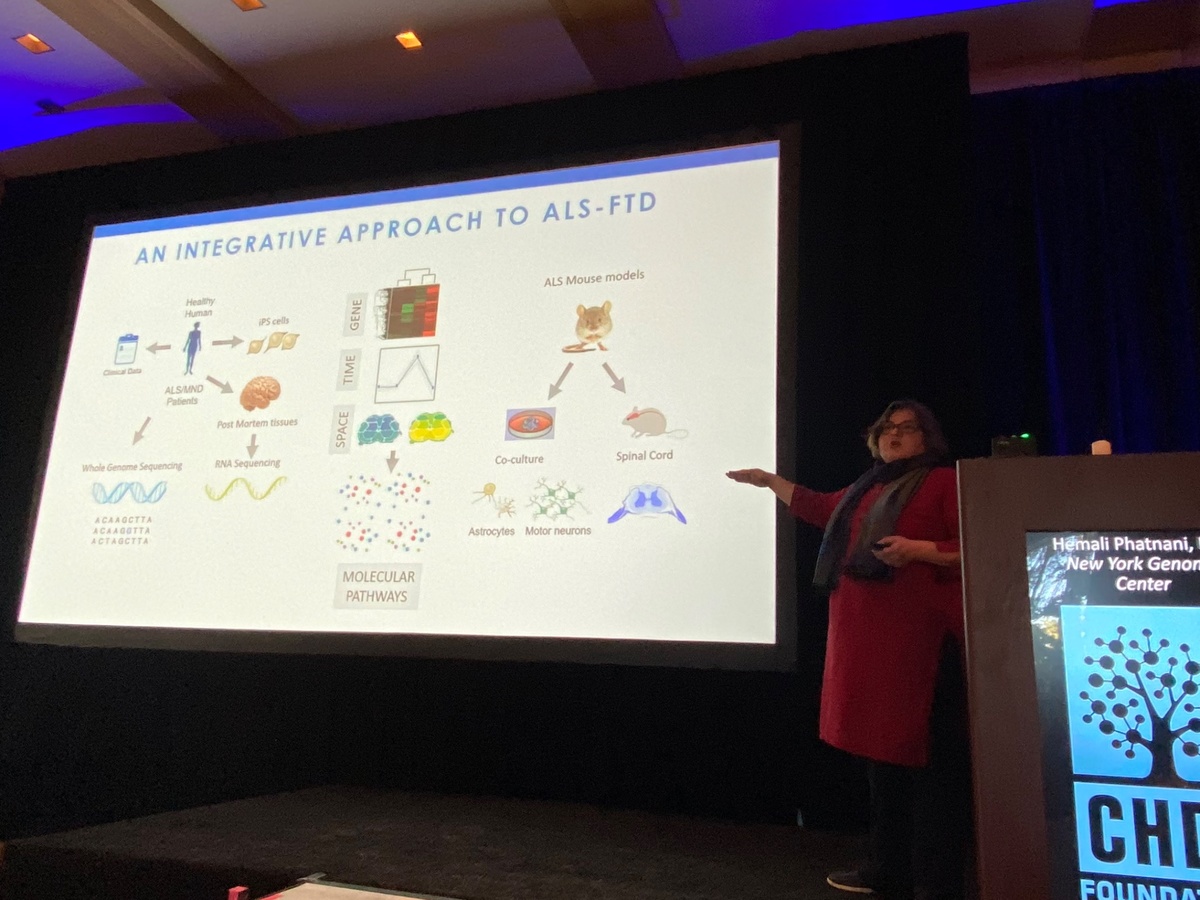
Prochain intervenant : Hemali Phatnani, du centre du génome de New York, qui décrit ses travaux pour comprendre les modifications dans le cerveau et la moelle épinière des patients atteints de la sclérose latérale amyotrophique (maladie de Lou Gehrig) ou d’une autre maladie apparentée appelée DFT(démence fronto-temporale). Phatnani travaille avec un grand nombre de centres médicaux SLA pour accéder à des échantillons rares donnés par des patients SLA. Ceux-ci sont analysés et les données mises immédiatement à la disposition des chercheurs du monde entier, un excellent modèle de science ouverte ! Comme la maladie de Huntington, la sclérose latérale amyotrophique est une maladie complexe ; différents types de cellules cérébrales subissent différents changements au cours de la maladie. L’équipe de Phatnani a aidé à développer de nouvelles méthodes pour cartographier les changements dans les cellules du cerveau SLA, lui permettant d’étudier des changements spécifiques au niveau de la cellule, et leurs données sont disponibles pour tout chercheur (ou non-chercheur curieux), à explorer sur le site als-st.nygenome.org.
Ensuite, Sumanjit Jayadev de l’Université du Centre Médical de Washington, qui s’intéresse à l’étude d’un type particulier de cellule cérébrale appelée microglie. La microglie (ensemble de cellules microgliales) joue un rôle dans la progression de la MH et se débarrasser de ces cellules dans les modèles murins peut aider à soulager les symptômes MH. Les scientifiques savent depuis un certain temps que la maladie de Huntington provoque une réponse inflammatoire, et Jayadev s’intéresse aux cellules cérébrales (autres que les neurones) jouant un rôle dans cette inflammation. Les gènes impliqués dans l’inflammation sont des facteurs de risque de la maladie d’Alzheimer. Jayadev cherche par quelles cellules cérébrales sont activés ces gènes afin d’identifier le risque de maladie en utilisant une technique qui fournit des données au niveau des cellules individuelles. L’analyse de ces changements dans les cellules individuelles a permis aux chercheurs d’identifier des sous-types de microglies et en examinant ces sous-types, d’identifier un type particulier de microglie uniquement présent dans la maladie d’Alzheimer. Avec toutes les données générées, celui-ci peut surveiller la progression de la maladie d’Alzheimer en observant quels gènes sont activés, où et quand. Ce travail peut aider à définir les différentes populations de patients, et aider les médecins et les chercheurs à comprendre le fonctionnement du processus pathologique. Si les chercheurs peuvent appliquer ce travail à la maladie de Huntington, alors à l’avenir en connaissant l’âge et la longueur CAG d’un patient, les médecins pourraient prendre des décisions éclairées sur la manière de traiter un patient spécifique.
Le prochain intervenant est William Yang, un chercheur de l’Université de Californie à Los Angeles, qui étudie la MH. Le laboratoire de Yang génère de nombreux ensembles de données vraiment volumineux à partir de différents modèles de souris MH, analysant comment sont activés les différents gènes, quelles protéines sont présentes dans différents type de cellules et rassemble toutes ces données pour les comparer à celles des souris témoins (souris ordinaires). Dans ces gros ensembles de données, les scientifiques peuvent rechercher des modèles et des corrélations qui pourraient indiquer comment certains gènes travaillent ensemble dans des modèles murins MH. Ces modèles peuvent être cartographiés à l’aide de méthodes de calcul afin de comprendre comment certains types de cellules cérébrales contribuent au changement dans les expressions génétiques observées.
Lors de cet exposé, Yang s'est concentré sur l’analyse effectuée à l’aide de souris témoins non atteintes de MH au cours de laquelle son équipe a montré que cette technique identifiait d’importantes fonctions et des types de cellules contribuant à ces fonctions. Lorsque les données issues du modèle murin MH sont placées sur la carte, les chercheurs constatent que les gènes régulant les cycles sommeil/éveil et la réparation de l’ADN ont été modifiés, confirmant les découvertes rapportées auparavant. Cette cartographie peut également être utilisée pour tester de nombreuses nouvelles théories des chercheurs sur la MH, un outil bienvenu !
Mardi après-midi - Le processus d'instabilité somatique
La session de l'après-midi se concentre sur le processus de ** l'instabilité somatique **.
En termes simples, l’instabilité somatique apparaît lorsque de longues répétitions de séquences ADN sont instables dans certains types de cellules.
Le premier intervenant est Darren Monckton de l’Université de Glasgow, lequel s’intéresse à l’étude de la manière dont l’instabilité somatique peut conduire à la maladie de Huntington et à la manière de cibler l’instabilité qui pourrait être une bonne stratégie pour le développement de nouveaux médicaments. Les scientifiques savent depuis un certain temps maintenant que la longueur du triplet CAG peut varier dans les tissus avec certaines cellules possédant des répétitions CAG plus longues que d’autres. La variation dans la longueur de la répétition du triplet CAG augmente à mesure que les patients vieillissent, ce qui suggère qu’il existe plus d’instabilité. De même, plus la répétition CAG est longue, plus la variabilité est grande et donc plus elle déclenche l’instabilité. Il convient de préciser que cela ne signifie pas que le nombre CAG s'allonge globalement à mesure que l'on vieillit, il restera le même mais cela signifie simplement que la longueur de répétition CAG peut parfois augmenter dans quelques cellules.
Le triplet CAG code pour l’acide aminé glutamique, c'est pourquoi on entend parfois la MH appelée maladie de polyglutamine. Mais les glutamines peuvent également être codées par le triplet CAA et par conséquent, bien que l’ADN soit différent, la protéine qui est produite sera la même avec un CAG substitué avec un CAA. Cela se produit, par exemple dans le gène MH, où une longue répétition du triplet ‘C-A-G’ s'allonge dans des types de cellules.Il y a un article plus détaillé sur HDBuzz à ce sujet ici.
Une récente découverte intéressante a montré que la présence de CAA à certains endroits, plutôt que des CAG, est meilleure pour maintenir la stabilité de la longueur de répétition. La prochaine question qui se pose alors : qu’est-ce qui conduit aux changements causant l’instabilité somatique ? Aucun élément de preuve n’apparaît sur la réparation de l’ADN, un récent sujet d’actualité dans le cadre de la recherche MH.
L’identification de “meneurs” spécifiques (ou gènes) de cette instabilité pourrait avoir des implications thérapeutiques dans le cadre de la MH. Les chercheurs s’efforcent maintenant à comprendre lesquels de ces meneurs sont les plus importants chez les patients, ainsi qu’à déterminer ceux qui peuvent être ciblés avec une nouvelle thérapie ou un nouveau médicament. Ils cherchent à savoir comment l’instabilité ou les modifications dans la longueur du triplet CAG varient pour un patient spécifique au fil du temps, tout cela grâce aux patients qui ont fourni des échantillons et des données dans le cadre de l’étude EnrollHD.
Si on peut surveiller et suivre la progression de la MH en mesurant l’instabilité avec un simple test sanguin, cela pourrait être un moyen moins intrusif pour les médecins afin de surveiller l’évolution de la maladie chez les patients et suggérer la meilleure façon de les traiter.
Prochain intervenant : Karen Usdin de l’Institut Américain de la Santé (NIH) qui a étudié l’instabilité somatique chez des modèles murins d’une maladie différente qui affecte le système nerveux appelée le syndrome de l’X fragile. Comme la maladie de Huntington, le syndrome de l’X fragile est une maladie liée aux répétitions de triplets mais au lieu de répétitions de triplets CAG, cette maladie a des répétitions du triplet CGG. On peut apprendre beaucoup de ces autres maladies liées aux répétitions de triplets car les scientifiques pensent qu'il existe de nombreuses similitudes entre les meneurs de maladies. Ainsi, comme dans le cadre de la MH, les répétitions du triplet CGG, responsable du syndrome de l’X fragile, sont affectées par l’instabilité somatique et les gènes impliqués dans la réparation de l’ADN influencent ce processus. Usdin a découvert, au moins chez les souris X fragiles, que la modification des taux de gènes de réparation de l'ADN empêche l'expansion de la répétition CGG et supprime même certaines des répétitions ! C’est très bien d’entendre à cette conférence des scientifiques extérieurs au domaine de la MH qui partagent de nombreuses idées et de connaissances intéressantes qui pourraient être utiles pour faire avancer plus rapidement la recherche MH !
Prochain intervenant : Ravi Lyer de la fondation CHDI, exposant l’un des programmes de découverte de médicaments intéressant les scientifiques. L’un des objectifs de ce programme est d’identifier de petites molécules. La fondation CHDI travaille avec de nombreuses compagnies différentes afin de découvrir des petites molécules en utilisant différentes techniques. L’un des moyens pour identifier des petites molécules qui pourraient agir est d’examiner des modèles détaillées de structures de molécules que les chercheurs veulent cibler, telles que les protéines impliquées dans la réparation de l’ADN. Le plus intéressant dans ces programmes visant à identifier des petites molécules est qu'elles pourraient être prises sous forme de pilules si elles s’avéraient être des traitements efficaces pour la MH. Bien que la perspective de traitements par des petites molécules soit très intéressante, les chercheurs doivent être extrêmement prudents afin que celles qu’ils souhaitent utiliser n’aient pas d’effets secondaires inattendus.
La mise au point de petites molécules, qui pourraient être des médicaments pour la MH, est un projet passionnant, mais on est encore loin de savoir si cela réussira. Une grande équipe de scientifiques dirigée par la fondation CHDI travaille dur dans ce sens.
Prochain intervenant : Brian Bettencourt de la compagnie Triplet Therapeutics, l'une des nombreuses entreprises travaillant dans ce domaine, qui en dira plus sur le ciblage thérapeutique de l'instabilité somatique. L’un de ses objectifs est de stopper l’instabilité somatique des répétitions CAG et de retarder le début de la maladie de Huntington. Ce domaine de recherche est si prometteur que les scientifiques doivent prioriser les molécules sur lesquelles travailler en premier. Après avoir priorisé des molécules candidates pour l’innocuité et le faible risque, le groupe Bettencourt a développé des molécules ciblant huit gènes différents. Bien qu’il s’agisse d’un grand nombre de cibles, il s’agit d’un nombre suffisamment petit pour être réalisé assez rapidement. Encore une fois, cette recherche fait partie d'une collaboration plus large, car Bettencourt travaille avec Jeff Carroll de HDBuzz pour étudier ces différentes cibles thérapeutiques potentielles. Le groupe Bettencourt devrait faire un compte-rendu sur certaines de ces études l'année prochaine.
Le dernier intervenant de la journée est Jeff Carroll, fondateur du site HDBuzz, qui clôturera la séance sur l’instabilité somatique. Carroll s’intéresse notamment à la compréhension de l’effet de la diminution de la huntingtine sur les tissus non-cérébraux, tels que le foie. Fait intéressant, la diminution de huntingtine réduit spécifiquement l'instabilité somatique dans certains tissus mais pas dans d'autres. Le laboratoire du Dr Carroll a voulu comprendre ces résultats plus en détail et collabore donc avec Sarah Tabrizi pour examiner les cellules des neurones humains.
La diminution de huntingtine chez un modèle murin différent, qui n’est pas atteint de la MH (mais atteint de l’ataxie, une maladie liée à des répétitions CAG différentes), montre que l'instabilité somatique y est également réduite, suggérant peut-être que la protéine huntingtine en général a un rôle dans l'instabilité somatique. Si la huntingtine joue un rôle dans la stabilité du génome, et dans quelle mesure notre ADN est maintenu, le laboratoire Carroll tient à déterminer la manière dont cela pourrait se produire et affecter les patients MH. Il s'agit d'une toute nouvelle observation, alors les scientifiques sont ravis d'explorer cette découverte !
Et c'est tout pour le premier jour ! Ne manquez pas nos prochains comptes-rendus et suivez la conversation sur Twitter.


