Détails sur le premier essai clinique de thérapie génique pour la maladie de Huntington
UniQure annonce les principaux détails de son essai prévu pour évaluer la sécurité et la capacité de la thérapie génique AMT-130 à réduire la protéine huntingtine problématique à l’aide d’un système d’administration de virus « à dose unique ».
Lors de la récente convention annuelle de la Huntington’s Disease Society of America à Boston, UniQure a annoncé des détails cruciaux sur son essai clinique prévu pour son traitement expérimental, AMT-130. Nous avons déjà écrit sur l’AMT-130 ici, cet article couvre donc les bases et ce qui vient d’être annoncé.
La thérapie génique de réduction de la huntingtine en bref
AMT-130 est un traitement de réduction de la huntingtine, car il vise à réduire la production de la protéine huntingtine mutante nocive, qui est nocive pour les neurones et est la cause de la maladie de Huntington.

Cependant, l’AMT-130 diffère de plusieurs manières importantes des essais d’oligonucléotides antisens (ASO) qui sont actuellement en cours, menés par Roche et Wave Life Sciences.
AMT-130 est une thérapie génique, ce qui signifie qu’elle cherche à modifier de façon permanente la composition génétique du patient traité. AMT130 n’essaie pas de supprimer la mutation HD – c’est beaucoup plus difficile à réaliser qu’on ne le pense. Au lieu de cela, AMT130 utilise un virus inoffensif connu sous le nom de virus adéno-associé (AAV) pour
Une fois qu’un neurone est traité avec AMT-130, il fabriquera continuellement des copies supplémentaires de la nouvelle molécule de réduction de la huntingtine. Ainsi, bien que le neurone contienne toujours le gène HD nocif et envoie toujours des messages pour fabriquer la protéine huntingtine mutante,
Qu’en est-il de l’essai ?
UniQure a annoncé quelques détails préliminaires mais importants sur son essai prévu dans une déclaration à la communauté MH. Voici ce que nous savons jusqu’à présent.
L’objectif du premier essai sera la sécurité et la tolérabilité : déterminer s’il existe des effets nocifs ou désagréables liés à la réception du traitement AMT-130.
UniQure inclut également l’efficacité dans les objectifs déclarés de l’étude : cela signifie avoir une idée de si le traitement fait ce qu’il est censé faire. Au sens large, cela signifie ralentir la progression de la maladie de Huntington. Il est théoriquement possible, mais très peu probable, que ce premier petit essai montre des preuves de ralentissement de la progression. Un objectif plus réalisable est de tester si le traitement réduit la production de huntingtine, ce que nous pouvons maintenant mesurer en utilisant des techniques que nous avons décrites sur HDBuzz ici.
L’essai AMT-130 sera basé sur des sites cliniques MH aux États-Unis. Nous ne savons pas encore quels sites ni combien. Ceux-ci seront annoncés publiquement lorsqu’ils seront mis en ligne. UniQure espère commencer à recruter des patients avant la fin de 2019.
L’essai recrutera seulement 26 patients présentant des symptômes précoces de la maladie de Huntington. Cela signifie des personnes ayant des mouvements anormaux, dans les premières années après que le diagnostic a été « officiellement » confirmé par un neurologue. La tranche d’âge est de 25 à 65 ans.
Fait inhabituel, uniQure a fixé une limite de 44 répétitions CAG ou plus dans le gène HD. Environ 50 % des personnes ayant un test génétique positif pour la MH ont entre 40 et 45 répétitions, cette limite pourrait donc exclure pas mal de personnes. Il est probable qu’uniQure ait fixé cette limite pour orienter l’essai vers des personnes susceptibles de progresser plus rapidement, afin qu’elles aient une meilleure chance de montrer que l’AMT-130 ralentit la progression.
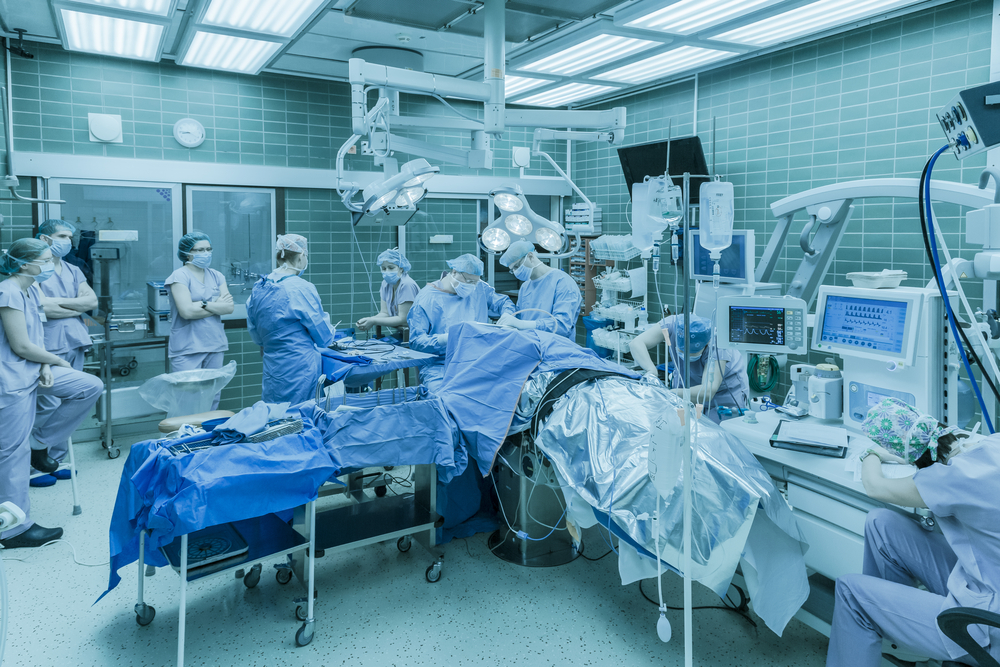
Les 26 patients seront répartis au hasard en deux groupes. 16 patients recevront un
L’avantage potentiellement important du traitement avec AMT-130 est qu’il n’est effectué qu’une seule fois par participant, mais c’est une affaire importante. Il implique une chirurgie cérébrale, réalisée sous anesthésie générale. Entre deux et six petits trous seront percés dans le crâne, et de fins tubes appelés cathéters seront insérés dans le cerveau. Le cocktail AMT-130 est ensuite injecté dans les tubes dans le cerveau.
Les patients affectés au traitement d’imitation subiront une anesthésie générale, et des trous peu profonds seront percés dans la couche externe du crâne, mais ne la traverseront pas complètement. Aucun tube ni injection ne sont impliqués.
Le but du groupe d’imitation est d’aider à déterminer si les effets observés dans l’essai – qu’ils soient utiles ou nocifs – sont causés par la thérapie AMT-130 elle-même, l’effet placebo (le coup de pouce psychologique qui vient du fait de participer à un essai clinique) ou les effets de l’anesthésie et de la chirurgie.
Les patients seront suivis intensivement pendant 18 mois, avec des examens comprenant des IRM et des ponctions lombaires (ponctions spinales). Les patients du groupe actif seront ensuite invités à revenir pour des visites annuelles pendant 5 ans.
L’équipe neurochirurgicale saura quels patients sont dans quel groupe, mais le patient et l’équipe de l’essai MH ne le sauront pas. Cela signifie que l’étude est en double aveugle et aide à minimiser l’effet placebo, permettant à l’essai d’atteindre son objectif scientifique de déterminer si le médicament est sûr et s’il fonctionne.
L’avantage pour les patients affectés au groupe d’imitation est que 18 mois après leur mini-opération, si un examen indépendant des données de l’essai est satisfaisant, ils seront invités à subir un traitement complet avec AMT-130 lors d’une deuxième opération plus importante.
Risque et récompense
Le principal avantage potentiel de l’AMT-130 est également son plus grand inconvénient potentiel. C’est une thérapie génique, donc un seul traitement devrait être permanent.
Si tout se déroule comme prévu, ce sera un traitement qui pourrait être administré tôt après un résultat positif au test génétique, qui aura des avantages durables, voire à vie. Il pourrait ralentir la progression ou même retarder l’apparition de la MH sans nécessiter de doses répétées.
Cependant, si le traitement s’avère avoir des effets secondaires nocifs, ceux-ci pourraient également être durables – et il n’y a aucun moyen d’arrêter le traitement une fois qu’il a été administré. À titre d’exemple purement fictif, que se passerait-il si le traitement provoquait pour une raison quelconque une aggravation du contrôle des mouvements, une accélération de la maladie de Huntington de la personne ou une sensation permanente de nausée ? Les patients pourraient se retrouver avec des symptômes majeurs, voire des handicaps. L’équipe médicale ferait tout son possible pour améliorer les choses, mais retirer le traitement ou l’arrêter ne sera pas une option.
Un autre détail important est que l’AMT-130 est conçu pour réduire la production des deux formes de la protéine huntingtine – pas seulement la forme mutante nocive, mais aussi son innocente sœur « normale », que les scientifiques appellent « sauvage ». Une préoccupation est que la réduction de la huntingtine sauvage dans le cerveau des adultes atteints de MH pourrait comporter ses propres risques, qui pourraient éclipser tous les avantages de la réduction de la protéine mutante. Ces préoccupations proviennent en grande partie d’expériences menées sur des souris, qui ont toutes des différences majeures par rapport aux patients humains, et pour le moment, les effets réels de la réduction de la huntingtine sauvage chez les patients sont inconnus. Des informations importantes à ce sujet proviendront, espérons-le, des deux programmes de réduction de la huntingtine en cours impliquant des injections de médicaments dans la colonne vertébrale : le RG6042 de Roche, qui réduit les deux formes de la protéine, et le programme Precision-HD de Wave, qui tente de réduire sélectivement la forme mutante.
L’AMT-130 a été testé sur des animaux et n’aurait pas été autorisé à passer à un essai sur l’homme si des risques inacceptables avaient été découverts. Mais seuls les humains peuvent nous dire quels avantages et quels inconvénients pourraient être observés. En plus des risques liés à la chirurgie, les patients qui envisagent de se porter volontaires pour cet essai peuvent s’attendre à être soigneusement conseillés sur les risques possibles, sans aucune attente ferme qu’ils en bénéficieront personnellement. Il sera demandé à ces volontaires de faire un sacrifice important au nom des autres – ceux qui se portent volontaires pour les premiers essais sur l’homme sont parmi les plus grands héros individuels de la communauté MH.
Une avancée importante
Ici, à HDBuzz, notre cocktail préféré s’appelle Espoir substantiel. C’est à parts égales d’optimisme et de réalisme. Après nos précédents reportages sur les thérapies de réduction de la huntingtine, nous avons reçu des commentaires selon lesquels nous sommes trop positifs, et d’autres selon lesquels nous sommes trop négatifs (le mot « HDBuzzKill » a même été utilisé, et nous sommes d’accord avec cela). Peut-être que cela signifie que nous nous en sortons à peu près bien – mais c’est à vous de décider.
Nous encourageons tous les lecteurs à obtenir leurs informations auprès de plusieurs sources. Notre article « Dix règles d’or », publié en 2011, pourrait vous aider à cultiver un esprit ouvert aux nouvelles idées intéressantes, mais sainement sceptique face au battage médiatique. Nous sommes sans vergogne en faveur des membres de la famille MH qui se portent volontaires pour des projets de recherche, y compris des essais cliniques : c’est la seule façon dont nous ferons de réels progrès dans la lutte contre la maladie de Huntington. Nous encourageons toute personne qui envisage de se porter volontaire à peser les risques et les avantages et à demander conseil à des personnes intelligentes en qui vous avez confiance, avant de s’inscrire.
Notre point de vue sur l’AMT-130 : le premier essai de thérapie génique de réduction de la huntingtine a le potentiel d’ouvrir la voie à une nouvelle génération de médicaments véritablement révolutionnaires. Ceux qui y participent ne sont pas moins courageux que les astronautes qui ont marché sur la surface de la lune il y a presque exactement cinquante ans. Au risque personnel important, ils se porteront volontaires pour faire un pas pas si petit vers l’inconnu, dans l’espoir de faire un bond de géant pour les familles MH.
Nous publierons d’autres mises à jour sur ce programme et d’autres programmes de réduction de la huntingtine au fur et à mesure de leur développement.
En savoir plus
Sources et références
Pour plus d’informations sur notre politique de divulgation, consulte notre FAQ…